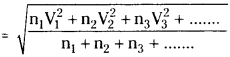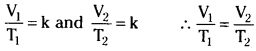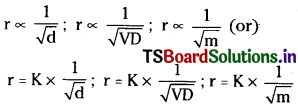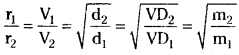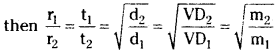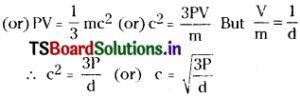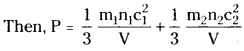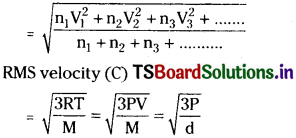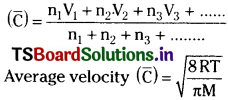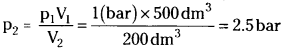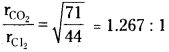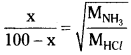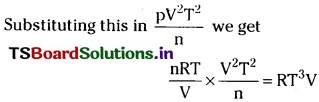Telangana TSBIE TS Inter 1st Year Chemistry Study Material 4th Lesson States of Matter: Gases and Liquids Textbook Questions and Answers.
TS Inter 1st Year Chemistry Study Material 4th Lesson States of Matter: Gases and Liquids
Very Short Answer Type Questions
Question 1.
Name the different intermolecular forces experienced by the molecules of a gas.
Answer:
The intermolecular forces experienced by the molecule of a gas are
- Dispersion forces or London forces,
- Dipole-dipole forces,
- Dipole-induced dipole forces.
- Ion-dipole forces.
The above three forces (first, second and third) are collectively called van der Waals’ forces.
Question 2.
State Boyle’s law. Give its mathematical expression.
Answer:
Boyle’s law:
At constant temperature, the pressure of a given mass of gas is inversely proportional to its volume.
Mathematically it can be written as
P ∝ \(\frac{1}{V}\) (at constant T and n)
P = \(\frac{k}{V}\) ‘k’ is proportionality constant
PV = k
Question 3.
State Charles’ law. Give its mathematical expression.
Answer:
At constant pressure the volume of a given mass of gas is directly proportional to its absolute temperature. Mathematically it can be written as
V ∝ T (P and n are constant)
V = kT ‘k’ is proportionality constant.
\(\frac{V}{T}\) = k
Question 4.
What are Isotherms?
Answer:
The curves which show relationship between variation of volume of a given mass of gas and pressure at constant temperature are called Isotherms.
Question 5.
What is Absolute Temperature?
Answer:
At this temperature, the volume of every gas should be equal to zero. Hence this value (- 273°C) of temperature is called absolute zero.

Question 6.
What are Isobars?
Answer:
The lines in the graph showing relationship between the variation of volume of gas with temperature at constant pressure are called Isobars.
Question 7.
What is Absolute Zero?
Answer:
The lowest hypothetical or imaginary temperature at which gases are supposed to occupy zero volume is called absolute zero.
Question 8.
State Avogadro’s law.
Answer:
Equal volumes of all gases under the same conditions of temperature and pressure contain equal number of molecules. Mathematically it can be written as V ∝ n (P and T are constant).
Question 9.
What are Isochores?
Answer:
The lines in the graph showing the relationship between the variation of pressure of gas with temperature at constant volume are called isochores.
Question 10.
What are S.T.P conditions?
Answer:
Standard temperature = 0°C = 273 K
Standard pressure = 1 atmosphere = 76 cm of Hg = 760 mm ofHg
Volume of 1 mole of gas at STP = 22.4 lit.
Question 11.
What is Gram molar volume?
Answer:
The volume occupied by 1 mole any gas at STP is 22.4 lit. This volume is known as gram molar volume.
Question 12.
What is an Ideal gas?
Answer:
The gas which obeys all gas laws at all temperatures and pressures is called an Ideal gas.

Question 13.
Why the gas constant ‘R’ is called universal gas constant?
Answer:
The value of gas constant R is same for all gases, and is independent of the nature of gas. Hence it is called universal gas constant.
Question 14.
Why Ideal gas equation is called Equation of State?
Answer:
Ideal gas equation is a relation between four variables and it describes the state of any gas, therefore it is also called equation of state.
Question 15.
Give the values of gas constant in different units.
Answer:
If pressure is in Newton m-2, then R = 8.314 joule mol-1K-1
If pressure is in dm , then R = 1.987 cal mol-1R-1
Question 16.
How are the density and molar mass of a gas related?
Answer:
The relationship for calculating molar mass of a gas
M = \(\frac{dRT}{P}\) (or) d = \(\frac{PM}{RT}\)
M = molar mass; d = density of gas;
R = gas constant;
T = absolute temperature;
P = pressure of gas.
Question 17.
State Graham’s law of diffusion. [Mar. ’18 (AP & TS) (IPE ’14, ’10)]
Answer:
At constant temperature and pressure, the rate of diffusion of a gas is inversely proportional to the square root of its density or vapour pressure or molecular weight.
Question 18.
Which of the gases diffuses faster among N2, O2 and CH4? Why? [TS ’16, ’15]
Answer:
Methane gas diffuses faster than N2 and O2 because the molecular weight of Methane (16) is lesser than the molecular weights of N2 (28) and O2 (32).
Question 19.
How many times methane diffuses faster than sulphur dioxide?
Answer:
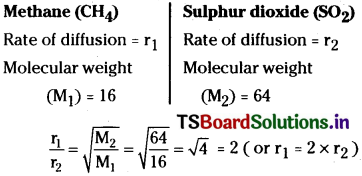
∴ Methane gas diffuses 2 times faster than SO2.
Question 20.
Sate Dalton’s law of partial pressures. [IPE ’14]
Answer:
At constant temperature, the total pressure exerted by a mixture of gases which do not react chemically with each other, is equal to the sum of the partial pressures of the component gases.
Question 21.
Give the relation between the partial pressure of a gas and its mole fraction.
Answer:
Partial pressure = Total pressure × Mole fraction
pi = \(\frac{n_i}{n}\) × P
Question 22.
What is aqueous tension?
Answer:
Pressure exerted by saturated water vapour is called aqueous tension.

Question 23.
Give the two assumptions of Kinetic molecular theory of gases that do not hold good in explaining the deviation of real gases from ideal behaviour.
Answer:
- The actual volume occupied by gas molecules is negligible when compared to the total volume of gas.
- There are no attractions or repulsions among the gas molecules.
Question 24.
Give the kinetic gas equation and write the terms in it.
Answer:
Kinetic gas equation PV = \(\frac{1}{3}\) mnu²rms
Where,
P = Pressure of the gas
V = Volume of the gas
m = mass of one molecule of the gas
n = number of molecules of the gas
urms = RMS speed of the gas molecules.
Question 25.
Give an equation to calculate the kinetic energy of gas molecules.
Answer:
The kinetic energy of gas
Ek = \(\frac{3}{2}\) nRT
Ek = Kinetic energy;
R = Gas constant;
T = Absolute temperature;
n = Number of moles.
The kinetic energy for one molecule of gas
\(\frac{E_k}{N}=\frac{3}{2}(\frac{R}{N})T=\frac{3}{2}kT\) =
k is called Boltzmann constant and equal to \(\frac{R}{N}\).
Question 26.
What is Boltzman’s constant? Give its value.
Answer:
The value of gas constant per molecule is called Boltzmann constant (k = \(\frac{R}{N}\))
Its value is 1.38 × 10-23 joule K-1 mol-1 (or) 1.38 × 10-16 erg K-1 mol-1.
Question 27.
What is R.M.S speed?
Answer:
It is defined as the square root of the mean of the squares of the velocities of all the molecules present in the gas.
Let there be n1 molecules with V1 speed, n2 molecules with V2 speed, n3 molecules with V3 speed and so on
R.M.S speed
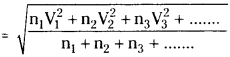
Question 28.
What is average speed?
Answer:
It is the arithmetic mean of velocities of gas molecules. Let there be n1 molecules with velocity V1, n2 molecules with velocity V2, n3 molecules with velocity V3 and so on.
The average velocity
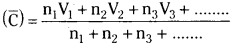
Question 29.
What is most probable speed? [Mar. ’11]
Answer:
The velocity possessed by maximum number of molecules in a given gas is called most probable velocity. It is denoted by CP.
Question 30.
What is the effect of temperature on the speeds of the gas molecules?
Answer:
As the temperature increases the fraction of molecules possessing low velocities decreases and the fraction of molecules possessing high velocities increases.

Question 31.
What is the effect of temperature on the kinetic energy of the gas molecules?
Answer:
Kinetic energy of the gas Ek = \(\frac{3}{2}\) nRT
For a given mass of gas \(\frac{3}{2}\) , n (number of moles) and R (gas constant) are constant.
∴ Ek ∝ T
So, kinetic energy of a gas is directly proportional to its absolute temperates and increases with increase in temperature.
Question 32.
Give the ratio of RMS, average and most probable speeds of gas molecules.
Answer:
CP : \(\overline{\mathrm{C}}\) : C = 1 : 1.128 : 1.224
Question 33.
Why RMS speed is taken in the derivation of kinetic gas equation?
Answer:
Velocity is a vector quantity. The molecules of a gas will move randomly in all possible directions. In one direction, if the velocity is taken as + ve, in the opposite direction it is – ve. Then sometimes the average velocity may become zero. To avoid this, all the velocities are squared, their mean is calculated and square root is taken for it. Then it will be the true average velocity and it is called RMS velocity.
Question 34.
What is compressibility factor?
Answer:
It is the ratio of the actual molar volume of a gas to the molar volume of a perfect gas under the same conditions.
For a perfect gas, the value of compression factor (Z) is 1.
Question 35.
What is Boyle’s temperature?
Answer:
The temperature at which a real gas obeys ideal gas law over an appreciable range of pressure is called Boyle s temperature.
Question 36.
What is critical temperature? Give its value for CO2.
Answer:
The temperature above which a gas cannot be liquified what ever the pressure applied is called critical temperature. At critical temperature or below critical temperature a gas can be liquified by applying pressure. For carbon dioxide its value = 30.98°C.
Question 37.
What is critical volume?
Answer:
The volume occupied by 1 mole of a gas at critical temperature and critical pressure is called critical volume.
Question 38.
What is critical pressure?
Answer:
The pressure required to liquify a gas at its critical temperature is called critical pressure.
Question 39.
What are critical constants?
Answer:
The critical temperature, critical pressure and critical volume are called critical constants.
Question 40.
Define vapour pressure of a liquid.
Answer:
The pressure exerted by the vapours of a liquid on the surface of the liquid when both of them are in equilibrium is called vapour pressure of the liquid.

Question 41.
What are normal and standard boiling points? Give their values for H2O.
Answer:
The temperature at which a liquid boils at atm pressure is called normal boiling point.
The temperature at which a liquid boils at 1 bar pressure is called standard boiling point.
For H2O the normal boiling point is 100°C and the standard boiling point is 99.6°C.
Question 42.
Why pressure cooker is used for cooking food on hills?
Answer:
At high altitudes atmospheric pressure is low. So at high altitudes liquids boil at low temperature where the food materials cannot be cooked. To increase the boiling temperature of water by increasing the pressure above atmospheric pressure, pressure cooker is used so that food materials can be cooked easily.
Question 43.
What is surface tension? [Mar. ’18 (AP)]
Answer:
The force acting downwards at right angles to the surface along unit length of the surface by the liquid molecules in the bulk is called surface tension. Its units are kgs-2 and in SI units Nm-i
Question 44.
What is laminar flow of liquid?
Answer:
The type of flow in which there is a regular gradation of velocity in passing from one layer to the next layer is called laminar flow.
Question 45.
What is coefficient of viscosity? Give its units.
Answer:
Coefficient of viscosity is the force when velocity gradient is unity and the area of contact is unit area. It is represented by η.
Units of viscosity coefficient η.
In SI units 1 newton second per square meter (Nsm-2) = Pascal second (Pas = 1 kgm-1s-1).
In CGS system the unit of viscosity is poise,
1 poise = 1 g cm-1s-1 = 10-1 kgm-1s-1.
Short Answer Questions
Question 1.
State and explain Boyle’s law.
Answer:
Boyle’s law:
At constant temperature, the volume of a given mass of gas is inversely proportional to the pressure of the gas.
Mathematically it can be written as
V ∝ \(\frac{1}{P}\) (at constant t and n)
or V = \(\frac{k}{P}\)
or PV = k
It means that at constant temperature, product of pressure and volume of a fixed amount of gas is constant.
If V1 is the volume of a given mass of a gas at pressure P1 and V2 is the volume of same mass of gas at pressure P2, then according to Boyle’s law P1V1 = P2V2.

Question 2.
State and explain Charles’ law.
Answer:
Charles’ law :
At constant pressure, the volume of a given mass of gas is directly proportional to its absolute temperature.
Mathematically it can be written as
V ∝ T (P and n are constant)
V = kT
or \(\frac{V{T}\) = k ;
k is proportionality constant.
Charles’ law can also be defined as for a fixed mass of gas at constant pressure, volume of a gas increases on increasing temperature and decreases on cooling. For each degree rise in temperature volume of the gas increases by \(\frac{1}{273.15}\) of the original volume of the gas at 0°C.
Thus if volumes of the gas at 0°C and t°C are V0 and Vt respectively then

If V1 is the volume of a gas at temperature T1 and V2 is the volume of same mass of gas at a temperature T2, then according to Charles’ law
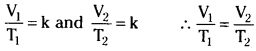
Question 3.
Derive Ideal gas equation. [TS Mar. ’19]
Answer:
By combining Boyle’s law, Charles’ law and Avogadro’s law, we get an equation which relates to volume, pressure, absolute temperature and number of moles. This equation is known as Ideal gas equation.
V ∝ \(\frac{1}{P}\) → Boyles’s law
V ∝ T → Charles’ law
V ∝ n → Avogadro’s law
Combining the above three laws, we can write
V ∝ \(\frac{1}{P}\) × T × n (or) V = R × \(\frac{1}{P}\) × T × n (or) PV = nRT
where V = Volume of the gas,
P = Pressure of the gas,
n = Number of moles of gas,
T = Absolute temperature,
R = Universal gas constant.
Question 4.
State and explain Graham’s law of Diffusion. [AP ’17; IPE ’14]
Answer:
Graham’s Law of Diffusion :
At constant temperature and pressure, the rate of diffusion of a gas is inversely proportional to the square root of its density (or) vapour pressure (or) molecular weight.
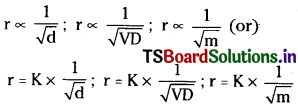
If r1 and r2 are the rates of diffusion of two gases and d1, r2 are their densities then
\(\frac{\mathrm{r}_1}{\mathrm{r}_2}=\sqrt{\frac{\mathrm{d}_2}{\mathrm{~d}_1}}\) …………… (1)
If r1 and r2 are the rates of diffusion of two gases and VD1, VD2 are their vapour pressures, then
\(\frac{\mathrm{r}_1}{\mathrm{r}_2}=\sqrt{\frac{\mathrm{V}{D}_2}{\mathrm{V}{D}_1}}\) …………… (2)
If r1 and r2 are the rates of diffusion of two gases and are their molecular

Case -1: If the times of diffusions are equal i.e., t1 = t2, then we can write
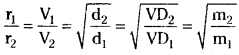
Case – 2 : If the volumes of the two gases are the same (i.e.,) V1 = V2
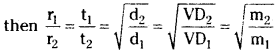
Question 5.
State and explain Dalton’s law of partial pressures. [AP ’16]
Answer:
Dalton’s law of partial pressure :
At constant temperature, the total pressure exerted by a gaseous mixture which do not react chemically with each other is equal to the sum of partial pressures of the component gases.
Consider a mixture of three gases in a vessel. Let p1, p2, p3 be the partial pressures of the three gases in the mixture. Let P’ be the total pressure exerted by the gaseous mixture. Then, according to Dalton’s law of partial pressure
P = p1 + p2 + p3
Question 6.
Deduce (a) Boyle’s law and (b) Charles’ law from kinetic gas equation. [AP 16; TS 15; May 13]
Answer:
a) Boyle’s law :
According to kinetic theory, the average K.E of gas molecules is directly proportional to the absolute temperature.
(i.e.,) KE ∝ T. But K.E = \(\frac{1}{2}\) mnc²
∴ \(\frac{1}{2}\)mnc² ∝ T (or) \(\frac{1}{2}\) mnc² = KT
According to kinetic gas equation,
PV = \(\frac{1}{3}\) mnc²
(or) PV = \(\frac{3}{2}\times\frac{1}{2}\) mnc²
(or) PV= \(\frac{2}{3}\) × KT (or) V = \(\frac{2}{3}\frac{K}{P}\) T.
If T is kept constant, then V
= Constant × \(\frac{1}{P}\) ( or ) V ∝ \(\frac{1}{P}\) (T constant)
At constant temperature, the volume of a given mass of gas is inversely proportional to its pressure. This is Boyle’s law.
b) Charles’ law :
According to kinetic theory, the average K.E of gas molecules is directly proportional to the absolute temperature. [AP Mar. ’19]
(i.e.,) K.E °c T, But K.E = \(\frac{1}{2}\) mnc²
∴ \(\frac{1}{2}\)mnc² ∝ T (or) \(\frac{1}{2}\)mnc² = KT
According to kinetic gas equation,
PV = \(\frac{1}{3}\) mnc²
(or) PV = \(\frac{2}{3}\times\frac{1}{2}\) mnc² (or) PV = \(\frac{1}{3}\) × KT
(or) V = \(\frac{2}{3}\frac{KT}{P}\)
If P’ is kept constant, then V = constant × T (or) V ∝ T (P constant)
At constant pressure, the volume of a given mass of gas is directly proportional to its absolute temperature. This is Charles’ law.
Question 7.
Deduce (a) Graham’s law and (b) Dalton’s law from kinetic gas equation. [AP Mar. ’19]
Answer:
a) Graham’s law:
According to kinetic gas equation, PV = \(\frac{1}{3}\) mnc²
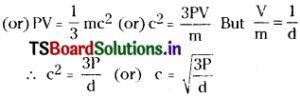
At constant pressure,
c = constant × \(\frac{1}{\sqrt{d}}\) (or) ∝ \(\frac{1}{\sqrt{d}}\)
In the case of gases r.m.s velocity (c) is directly proportional to rate of diffusion (r).
∴ r ∝ \(\frac{1}{\sqrt{d}}\) (At constant T and P)
i.e., At constant temperature and pressure the rate of diffusion of a gas is inversely proportional to the square root of its density. This is Graham’s law.
b) Dalton’s law of partial pressure :
Consider a given mass of gas (1) in a container of volume V.
Let number of molecules in the gas = n1;
Mass of each molecule = m1;
RMS velocity = c1
Then according to kinetic gas equation,
Pressure (P1) = \(\frac{1}{3}\frac{m_1n_1c_1^2}{V}\)
Now replace gas (1) by gas (2).
Let number of molecules in the gas = n2,
Mass of each molecule = m2;
RMS velocity = c2
Then according to kinetic gas equation,
Pressure (P2) = \(\frac{1}{3}\frac{m_2n_2c_2^2}{V}\)
Suppose, the two gases are mixed in the same container. Let the total pressure of the gas be P.
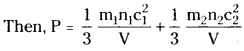
∴ P = P1 + P2. This is Dalton’s law of partial pressures.
(i.e.,) At constant temperature, the total pressure exerted by a mixture of gases which do not react chemically with each other is equal to the sum of partial pressures of the individual gases. This is Dalton s law of partial pressures.

Question 8.
Derive an expression for Kinetic energy of gas molecules.
Answer:
According to Kinetic gas equation,
PV = \(\frac{1}{3}\) mnc²
For 1 mole of gas, number of molecules, n = N,
where N = Avogadro’s number.
Then, PV = \(\frac{1}{3}\) mNC², where mN = gram molecular mass M’ of the gas, (mN = M)
∴ PV = \(\frac{1}{3}\)MC² = \(\frac{2}{3}\)(\(\frac{1}{2}\)MC²) = \(\frac{2}{3}\)Ek …………….. (1)
where Ek is K.E. of one mole of gas.
Ideal gas equation for 1 mole of a gas is
PV = RT …………… (2)
From (T) and (2), we get, \(\frac{2}{3}\) Ek = RT (or)
Ek = \(\frac{2}{3}\)RT
Since ‘R’ is a constant.
∴ Ek ∝ T
It means that, at a given temperature, 1 mole of any gas will have the same kinetic energy.
Dividing throughout by N’ (Avogadro’s number),
\(\frac{E_k}{N}\) = \(\frac{3}{2}\)(\(\frac{R}{N}\))T = \(\frac{3}{2}\)kT
\(\frac{R}{N}\)= k, where k is called, Boltzmann constant.
It is the gas constant per molecule.
∴ K.E. of ‘n’ moles of gas = nEk = \(\frac{3}{2}\)nRT
Question 9.
Define (a) rms (b) average and (c) most probable speeds of gas molecules. Give their interrelationship.
Answer:
a) RMS velocity:
It is defined as the square root of the mean of the squares of the velocities of all the molecules present in the gas.
Let there be n1 molecules with V1 velocity, n2 molecules with V2 velocity, n3 molecules with V3 velocity and so on.
Then, RMS velocity
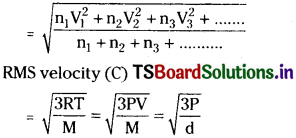
T= absolute temperature, M = Molecular weight, R = 8.314 × 107 erg K-1 mol-1.
b) Average velocity :
It is the arithmetic mean of velocities of gas molecules. Let there be n1 molecules with velocity V1, n2 molecules with velocity V2, n3 molecules with velocity V3 and so on.
Then Average velocity
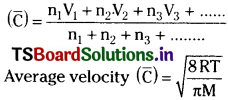
c) Most probable velocity :
The velocity possessed by maximum number of molecules is called most probable velocity. It is denoted by CP. CP = \(\sqrt\frac{2RT}{M}\)
Relation between different velocities :

Question 10.
Explain the physical significance of vander Waals’ parameters.
Answer:
Van der Waals’ equation [P + \(\frac{an^2}{V^2}\)](V-b)
= nRT,
In this equation P = Pressure of gas; V = volume of gas; n = number of moles of gas; T = absolute temperature a, b are constants called van der Waals’ constants. Value of ‘a’ is a measure of magnitude of intermolecular attractive forces within the gas and is independent of temperature and pressure.
At very low temperatures intermolecular forces become significant. Real gases show ideal behaviour when conditions of temperature and pressure are such that the intermolecular forces are negligible. The real gases show ideal behaviour when pressure approaches zero value of b. It is the measure of magnitude of the actual volume occupied by the gas molecules themselves. At high pressures the volume of the gas is very low. Then the volume occupied the gas molecules themselves cannot be neglected.
Question 11.
What is surface tension of liquids? Explain the effect of temperature on the surface tension of liquids. [Ap ’17]
Answer:
The phenomenon of surface tension is due to the existence of strong intermolecular forces of attraction in liquids.
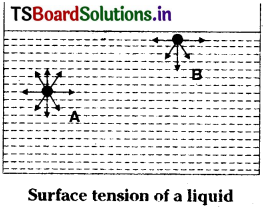
Consider a molecule (A) lying somewhere inside the liquid. This is attracted equally to all directions by other molecules surrounding it. So the net resultant force of attraction acting on this molecule is zero. This is true for all molecules present inside the body of the liquid. Now consider a molecule lying at the surface of the liquid (B). This is attracted by large number of molecules lying in the bulk of the liquid than by very few molecules lying above in the vapour phase. Thus a molecule at the surface experiences a net inward attraction. This is true for all molecules lying at the surface. As a result of this inward pull on all molecules lying at the surface, is not same. The surface behaves as if it were under tension like a stretched membrane. Hence this property of liquids is called surface tension.
The surface tension of a liquid is defined as “the force acting at right angles to the surface along unit length of the surface”. It is represented by D.
Examples:
- The liquid drops are spherical, due to surface tension. (For a given volume of liquid, sphere has the minimum surface area)
- At the critical temperature of liquids, the surface tension is zero.
- The rise of liquid in a capillary tube is due to surface tension.
Question 12.
What is vapour pressure of liquids? How the vapour pressure of a liquid is related to its boiling point?
Answer:
If a liquid is taken in an evacuated container a portion of liquid evaporates. This is due to collisions between the liquid molecules. The molecules which gets more energy due to molecular collisions within the liquid escape from the surface of liquid and goes into vapour. The pressure exerted by the vapours on the walls of container is called vapour pressure.
The vapour molecules also strike the surface of the liquid. If the kinetic energy of vapour molecules is less than the attractive forces of the liquid molecule on the surface of liquid the vapour molecules goes into liquid. It is known as condensation.
In the beginning, the rate of evaporation is more but the rate of condensation zero. As time posses the rate of evaporation decrease while the rate of condensation increases due to increase in vapour. After sometime the rate of evaporation and rate
of condensation become equal and an equilibrium is attained. At this stage the vapour pressure is constant and it is called saturated vapour pressure or equilibrium pressure.
When temperature of a liquid is increased the rate of vapourisation increases. The temperature at which the vapour pressure of a liquid becomes equal to the external pressure the liquid boils. The temperature at which the liquid boils is called boiling point.
At 1 atm pressure the boiling temperature is called normal boiling point. If pressure is 1 bar then the boiling point is called standard boiling point.

Question 13.
Define viscosity and coefficient of viscosity. How does the viscosity of liquids varies with temperature. [AP ’17]
Answer:
It is well known that all liquids do not flow with the same speed. Some liquids like water, alcohol, ether etc., flow very rapidly, while someone like glycerine, honey, castor oil etc., flow slowly. This indicates that every liquid has some internal resistance to flow. This internal resistance to flow possessed by a liquid is called its viscosity.
Liquids which flow rapidly have low internal resistance. So their viscosity is less. Liquids which flow slowly have high internal resistance. So their viscosity is high.
Coefficient of viscosity is the ‘force per unit area required to maintain unit difference of velocity between two parallel layers in the liquid, one unit apart’.
Units : Dyne cm-2 (C.G.S) or Poise.
Millipoise = 10-3 Poise.
Ns m-2 or Pa s (pascal second) is S.I. unit.
Examples:
- Glass is not a solid. It is a super-cooled liquid with a very high viscosity.
- H2SO4 is viscous, due to H – bonding.
Viscosity of liquids decreases as the temperature rises because at high temperature molecules have high kinetic energy and can overcome the intermolecular forces to slip past one another between layers.
Long Answer Questions
Question 1.
Write notes on intermolecular forces.
Answer:
The type of attraction that exists among the atoms in a covalent molecule is known as covalent bond’. The attraction forces that bind molecules together in a covalent substance are called intermolecular forces or van der Waal forces. These forces are of different types like lon-Dipole, Dipole – Di-pole, Dipole – Induced Dipole and Induced Dipole – Induced Dipole forces.
Ion – Dipole forces :
These forces are mainly present in aqueous solutions of ionic substances.
Ex : NaCl in water solution.
Water is a polar molecule and in it ‘H’ atoms possess partial +ve charge and O’ atoms possess partial – ve charge. When ionic compounds like NaCl dissolve in water, they dissociate into component ions like Na+ and Cl– Now, the water molecules orient in the presence of ions in such a way that the + ve end of the dipole is near an anion and the – ve end of the dipole is near a cation. The magnitude of interaction energy depends on the charge of the ion (Z), the strength of the dipole (µ) and on the inverse square of the distance (r) between the ion and the dipole. It can be expressed mathematically as,
E = Zµ/r²
Dipole – Dipole forces :
This type of forces exist between neutral polar molecules. These are due to the electrical interactions among dipoles on neighbouring molecules. These forces may be attractive (between unlike poles) or repulsive (between like poles) and depend on the orientation of the molecules. These forces are generally weak and are significant only when the molecules are in close contact. The strength of a given dipole-dipole interaction depends on the sizes of the dipole moments involved. The more polar the molecule or the higher the dipole moment, the greater is the strength of interactions and higher is the boiling points of those substances.
Dipole-Dipole interaction energy between solid polar molecules is proportional to \(\frac{1}{r^3}\) and that between rotating molecules is proportional to \(\frac{1}{r^6}\) where r’ is the distance between the polar molecules.
Induced dipole – Induced dipole forces (London dispersion forces):
To explain the intermolecular forces among individual atoms or non-polar molecules, London dispersion forces have been proposed. These forces result from the motion of electrons in an atom. At a given instant the electron distribution in an atom may be unsymmetrical giving the atom a short lived dipole moment. This instantaneous dipole on one atom can affect the electron distributions in neighbouring atoms and induce temporary dipoles in these neighbours.
As a result of which weak attractive forces develop. They are known as London forces or dispersion forces. These forces are small and are in the range 1-10 kJ/mole. The exact magnitude depends on a property known as polarisability. A smaller molecule or atom is less polarisable and has smaller dispersion forces. A larger molecule or heavier atom is more polarisable and has large dispersion forces. These forces are always attractive and are inversely proportional to the sixth power of the distance between the two interacting particles (r6).
Dipole-Induced Dipole forces:
These forces operate between polar molecules with permanent dipole moments and the molecules with no permanent dipole moment. Permanent dipole of the polar molecule induces dipole on the electrically neutral molecule by deforming the electron cloud. The interacting range is proportional to \(\frac{1}{r^2}\) where ‘r’ is the distance between the molecules. The magnitude of induced dipole moment also depends on the magnitude of the dipole moment of permanent dipole and polarisability of neutral molecule.
Question 2.
State Boyle’s law, Charles’ law and Avogadro’s law and derive ideal gas equation.
Answer:
Boyle’s law :
At constant temperature, the volume of a given mass of gas is inversely proportional to the pressure of the gas.
Mathematically it can be written as
V ∝ \(\frac{1}{P}\) (at constant t and n)
or V = \(\frac{k}{P}\)
or PV = k
It means that at constant temperature, product of pressure and volume of a fixed amount of gas is constant.
If V1 is the volume of a given mass of a gas at pressure P1 and V2 is the volume of same mass of gas at pressure P2, then according to Boyle’s law P1V1 = P2V2.
Charles’ law :
At constant pressure, the volume of a given mass of gas is directly proportional to its absolute temperature.
Mathematically it can be written as
V ∝ T (P and n are constant)
V = kT
or \(\frac{V{T}\) = k ;
k is proportionality constant.
Charles’ law can also be defined as for a fixed mass of gas at constant pressure, volume of a gas increases on increasing temperature and decreases on cooling. For each degree rise in temperature volume of the gas increases by \(\frac{1}{273.15}\) of the original volume of the gas at 0°C.
Thus if volumes of the gas at 0°C and t°C are V0 and Vt respectively then
If V1 is the volume of a gas at temperature T1 and V2 is the volume of same mass of gas at a temperature T2, then according to Charles’ law
Avogadro’s law :
Equal volumes of all gases under the same conditions of temperature and pressure contain equal number of molecules. Mathematically it can be written as V ∝ n (P and T are constant).
Ideal gas equation:
By combining Boyle’s law, Charles’ law and Avogadro’s law, we get an equation which relates to volume, pressure, absolute temperature and number of moles. This equation is known as Ideal gas equation.
V ∝ \(\frac{1}{P}\) → Boyles’s law
V ∝ T → Charles’ law
V ∝ n → Avogadro’s law
Combining the above three laws, we can write
V ∝ \(\frac{1}{P}\) × T × n (or) V = R × \(\frac{1}{P}\) × T × n (or) PV = nRT
where V = Volume of the gas,
P = Pressure of the gas,
n = Number of moles of gas,
T = Absolute temperature,
R = Universal gas constant.

Question 3.
Write notes on diffusion of Gases.
Answer:
Graham’s Law of Diffusion :
At constant temperature and pressure, the rate of diffusion of a gas is inversely proportional to the square root of its density (or) vapour pressure (or) molecular weight.
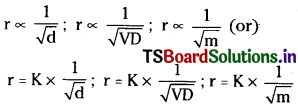
If r1 and r2 are the rates of diffusion of two gases and d1, r2 are their densities then
\(\frac{\mathrm{r}_1}{\mathrm{r}_2}=\sqrt{\frac{\mathrm{d}_2}{\mathrm{~d}_1}}\) …………… (1)
If r1 and r2 are the rates of diffusion of two gases and VD1, VD2 are their vapour pressures, then
\(\frac{\mathrm{r}_1}{\mathrm{r}_2}=\sqrt{\frac{\mathrm{V}{D}_2}{\mathrm{V}{D}_1}}\) …………… (2)
If r1 and r2 are the rates of diffusion of two gases and are their molecular

Case -1: If the times of diffusions are equal i.e., t1 = t2, then we can write
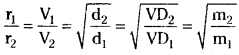
Case – 2 : If the volumes of the two gases are the same (i.e.,) V1 = V2
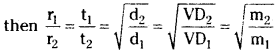
Question 4.
State and explain Dalton’s law of partial pressures. Derive the relation between partial pressure and total pressure.
Answer:
Dalton’s law of partial pressures:
“At constant temperature, the total pressure exerted by a gaseous mixture which do not react chemically with each other is equal to the sum of partial pressures of the component gases.”
Consider a mixture of three gases in a vessel. Let p1, p2, p3 be the partial pressures of the three gases in the mixture. Let P” be the total pressure exerted by the gaseous mixture. Then, according to Dalton’s law of partial pressure,
P = p1 + p2 + p3
Consider a fixture of three gases in a vessel of volume V at constant temperature T. Let the number of moles of these gases be n1 n2 and n3. Then according to Ideal gas equation
P1 = \(\frac{n_1RT}{V}\) …………… (1)
P2 = \(\frac{n_2RT}{V}\) …………… (2)
P3 = \(\frac{n_3RT}{V}\) …………… (3)
According to Dalton’s law of partial pressure,
Total pressure (P) = p1 + p2 + p3
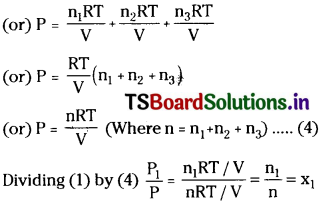
(or) P1 = P × x1
Similarly by dividing (2) by (4) and (3) by (4) we get
P2 =P × x2 & P = P3 × x2. Now we can write Total pressure = Partial pressure x mole fraction
Question 5.
Write the postulates of Kinetic Molecular Theory of Gases. [Mar. ’18 (TS); AP 16; TS 15; Mar, 13]
Answer:
Postulates of kinetic theory of gases:
- Every gas consists of a large number of tiny particles called molecules.
- The gas molecules are considered hard, spherical andperfectly elastic.
- The gas molecules move in all possible directions along a straight line path with very high velocities. As a result of which they collide with each other and also with the walls of the container. Hence their velocity and direction of motion continuously change.
- The actual volume occupied by gas molecules is negligible when compared to the total volume of the gas.
- There are jno attractions or repulsions among the gas molecules.
- There is no loss of Kinetic Energy (K.E.) when the gas molecules collide with each other or with the walls of the container.
- The pressure exerted by a gas is due to the bombardment of the gas molecules with the walls of the container.
- The average Kinetic Energy (K.E.) of gas molecules is directly proportional to the absolute temperature of the gas (or) average K.E. ∝ T.
- There is no gravitational force of attraction on the motion of gas molecules.
Question 6.
Deduce gas laws from kinetic gas equation.
Answer:
a) Boyle’s law :
According to kinetic theory, the average K.E of gas molecules is directly proportional to the absolute temperature.
(i.e.,) KE ∝ T. But K.E = \(\frac{1}{2}\) mnc²
∴ mnc² ∝ T (or) \(\frac{1}{2}\) mnc² = KT
According to kinetic gas equation,
PV = \(\frac{1}{3}\) mnc²
(or) PV = \(\frac{3}{2}\times\frac{1}{2}\) mnc²
(or) PV= \(\frac{2}{3}\) × KT (or) V = \(\frac{2}{3}\frac{K}{P}\) T.
If T is kept constant, then V
= Constant × \(\frac{1}{P}\) ( or ) V ∝ \(\frac{1}{P}\) (T constant)
At constant temperature, the volume of a given mass of gas is inversely proportional to its pressure. This is Boyle’s law.
b) Charles’ law :
According to kinetic theory, the average K.E of gas molecules is directly proportional to the absolute temperature. [AP Mar. ’19]
(i.e.,) K.E °c T, But K.E = \(\frac{1}{2}\) mnc²
∴ \(\frac{1}{2}\)mnc² ∝ T (or) \(\frac{1}{2}\)mnc² = KT
According to kinetic gas equation,
PV = \(\frac{1}{3}\) mnc²
(or) PV = \(\frac{2}{3}\times\frac{1}{2}\) mnc² (or) PV = \(\frac{1}{3}\) × KT
(or) V = \(\frac{2}{3}\frac{KT}{P}\)
If P’ is kept constant, then V = constant × T (or) V ∝ T (P constant)
At constant pressure, the volume of a given mass of gas is directly proportional to its absolute temperature. This is Charles’ law.
c) Graham’s law:
According to kinetic gas equation, PV = \(\frac{1}{3}\) mnc²
At constant pressure,
In the case of gases r.m.s velocity (c) is directly proportional to rate of diffusion (r).
∴ r ∝ \(\frac{1}{\sqrt{d}}\) (At constant T and P)
i.e., At constant temperature and pressure the rate of diffusion of a gas is inversely proportional to the square root of its density. This is Graham’s law.
d) Dalton’s law of partial pressure :
Consider a given mass of gas (1) in a container of volume V.
Let number of molecules in the gas = n1;
Mass of each molecule = m1;
RMS velocity = c1
Then according to kinetic gas equation,
Pressure (P1) = \(\frac{1}{3}\frac{m_1n_1c_1^2}{V}\)
Now replace gas (1) by gas (2).
Let number of molecules in the gas = n2,
Mass of each molecule = m2;
RMS velocity = c2
Then according to kinetic gas equation,
Pressure (P2) = \(\frac{1}{3}\frac{m_2n_2c_2^2}{V}\)
Suppose, the two gases are mixed in the same container. Let the total pressure of the gas be P.
∴ P = P1 + P2. This is Dalton’s law of partial pressures.
(i.e.,) At constant temperature, the total pressure exerted by a mixture of gases which do not react chemically with each other is equal to the sum of partial pressures of the individual gases. This is Dalton s law of partial pressures.

Question 7.
Explain Maxwell-Boltzmann distribution curves of molecular speeds and give the important conclusions. Discuss the effect of temperature on the distribution of molecular speeds.
Answer:
According to kinetic theory, the molecules in a gas travel randomly in all directions. During this random motion, they collide with each other and also with the walls of the container. As a result of which the molecular velocities constantly change from a low value close to zero to a very high value. In spite of large number of molecular collisions the ratio of the number of molecules with a certain velocity to the total number of molecules always remains constant. This ratio has been determined by statistical methods. Maxwell – Boltzmann gave the distribution curves of molecular velocities as shown in figure.
- Conclusions from the curve :A very small fraction of molecules has either very low or very high velocities.
- The highest point on the curve represents the most probable velocity of molecules. The velocity possessed by the maximum number of molecules in a given amount of gas is called most probable velocity.
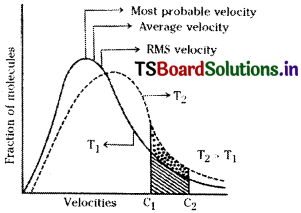
- The average velocity of molecules is higher than the most probable velocity of the molecules.
- R.M.S. velocity of the molecules is higher than the most probable velocity as well as average velocity of the molecules.
- As the velocities of the molecules increases, the fraction of the molecules possessing a particular velocity also increases, upto a maximum value and then decreases.
- As the temperature increases, the curve shifts to the right side, the height of the curve decreases and flattens a little. From this it can be known that, at high temperatures the fraction of the molecules possessing low velocities decreases and the fraction of molecules possessing high velocities increases.
Question 8.
Write notes on the behaviour of real gases and their deviation from ideal behaviour.
Answer:
Compression factor (Z) is very important to discuss the properties of real gases. It is the ratio of the actual molar volume of a gas to the molar volume of a perfect gas under the same conditions.
Compression factor (Z)

For a perfect gas, Z = 1. So for other values of Z (other than 1), real gases differ from ideal behaviour.
For real gases, Z varies with pressure. At low pressures, some gases have Z < 1. From this we can infer that their molar volumes are smaller than that of a perfect gas and the molecules cluster together slightly and attractive interactions are dominant. At high pressures Z > 1 for almost all gases. Z > 1 means that the molar volume of a gas is greater than that expected for a perfect gas. This is due to dominant repulsive forces which try to drive the molecules apart.
In general, at very low pressures all gases have almost ideal behaviour. At high pressures (Z = 1), it is difficult to compress. At intermediate pressures, most gases have Z < 1. Thus, gases show ideal behaviour when the volume occupied by them is large. Upto what pressure gases follow ideal behaviour, depends on the nature of the gas and its temperature.
The temperature at which a real gas obeys ideal gas laws Over a wide range of pressure is called Boyle temperature or Boyle point and it depends on the nature of the gas. Above Boyle temperature real gases show + ve deviations from ideality and their Z values are greater than 1. The forces of attractions between the gas molecules are feeble. Below the Boyle temperature, all real gases first show Z < 1 with increase of pressure and reaches a minimum. On further increase of pressure Z continuously increases. Hence, it may be concluded that at low pressure and high temperate gases show ideal behaviour.
Question 9.
Derive the van der Waals equation of state. Explain the importance of van der Waals’ gas equation.
Answer:
The repulsive interactions between two molecules cannot allow them to come closer than a certain distance. Therefore, for the gas molecules the available volume for free travel is not the volume of the container V. Hence, the volume is to be reduced to an extent proportional to the number of molecules and volume of each molecule Therefore, in the perfect gas equation a volume correction is to be made by changing V to (V – nb).
The effect of attractive interactions between molecules reduces the pressure of the gas. The attraction experienced by a given molecule is proportional to the concentration of the molecules (n/V) in the container. Moreover, the attractive interactions also reduce the strength of impact of molecules on the walls of the container (because of decrease in both collision frequency and velocity of the gas molecules). Therefore, we can expect that the reduction in pressure is proportional to the square of the molar concentration.
Reduction in pressure ∝ (\(\frac{n}{V}\))² (or)
Reduction in pressure = a (\(\frac{n}{V}\))²
where a = proportionality constant.
By taking into consideration correction in volume and correction in pressure we can write van der Waals’ equation as
(P + \(\frac{an^2}{V^2}\))(V – nb) = nRT
The constants a and b are known as van der Waals’ parameters. They depend on the nature of the gas and are independent of temperature.
Van der Waals’ equation is useful to know that under what conditions a real gas can behave as ideal gas.
At low pressures and high temperatures, the volume of the gas is very high. So the volume (b) occupied by the gas molecules by themselves can be neglected comparing to the volume of gas. Similarly at temperature the intermolecular forces (a) can be neglected. Then the van der Waals’ equation reduces to ideal gas equation.
But at high pressures and low temperatures the volume of the gas is very low. So the volume correction b cannot be neglected. Also, the intermolecular attractive forces also play important role. So the pressure correction a cannot be neglected. Then the real gas deviate from ideal gas behaviour.
Question 9.
Explain the principle underlying the liquefaction of gases.
Answer:
In order to liquefy a gas it must be cooled below its critical temperature. A gas can be liquefied by cooling it to below its boiling point at given pressure. But this type of technique is not possible for the liquefaction of gases like N2 and O2 which possess very low boiling points. To liquefy such type of gases a special technique based on intermolecular forces is to be used.
If we reduce the velocities of molecules to lower values then the neighbouring molecules attract each other, get cooled and condense to a liquid. In order to happen this, the gas is allowed to expand into available volume without supplying any heat from outside. In this process the attractions between the neighbouring molecules will be lessened. In doing so, the gas molecules convert some of their kinetic energy into potential energy and travel slowly. As a result of which the average velocity decreases and therefore the temperature of the gas decreases and the gas cools down. In order to happen this the gas is allowed to expand through a narrow opening called throttle. This way of cooling of gas by expansion from high pressure to low pressure is called Joule – Thomson effect. If the process is repeated several times by allowing the cooled gas again to mix up with the remaining gas by recirculation, finally the molecules get cooled to such a low temperature, and as a result of which the gas condenses to a liquid.
Question 10.
Write notes on the following properties of liquids
a) Vapour pressure b) Surface tension c) Viscosity.
Answer:
The phenomenon of surface tension is due to the existence of strong intermolecular forces of attraction in liquids.

Consider a molecule (A) lying somewhere inside the liquid. This is attracted equally to all directions by other molecules surrounding it. So the net resultant force of attraction acting on this iqoLecule is zero. This is true for all molecules present inside the body of the liquid. Now consider a molecule lying at the surface of the liquid (B). This is attracted by large number of molecules lying in the bulk of the liquid than by very few molecules lying above in the vapour phase. Thus a molecule at the surface experiences a net inward attraction. This is true for all molecules lying at the surface. As a result of this inward pull on all molecules lying at the surface, is not same. The surface behaves as if it were under tension like a stretched membrane. Hence this property of liquids is called surface tension.
The surface tension of a liquid is defined as “the force acting at right angles to the surface along unit length of the surface”. It is represented by D.
Examples:
- The liquid drops are spherical, due to surface tension. (For a given volume of liquid, sphere has the minimum surface area)
- At the critical temperature of liquids, the surface tension is zero.
- The rise of liquid in a capillary tube is due to surface tension.
b) Surface tension
If a liquid is taken in an evacuated container a portion of liquid evaporates. This is due to collisions between the liquid molecules. The molecules which gets more energy due to molecular collisions within the liquid escape from the surface of liquid and goes into vapour. The pressure exerted by the vapours on the walls of container is called vapour pressure.
The vapour molecules also strike the surface of the liquid. If the kinetic energy of vapour molecules is less than the attractive forces of the liquid molecule on the surface of liquid the vapour molecules goes into liquid. It is known as condensation.
In the beginning the rate of evaporation is more but the rate of condensation zero. As time posses the rate of evaporation decrease while the rate of condensation increases due to increase in vapour. After sometime the rate of evaporation and rate
of condensation become equal and an equilibrium is attained. At this stage the vapour pressure is constant and it is called saturated vapour pressure or equilibrium pressure.
When temperature of a liquid is increased the rate of vapourisation increases. The temperature at which the vapour pressure of a liquid becomes equal to the external pressure the liquid boils. The temperature at which the liquid boils is called boiling point.
At 1 atm pressure the boiling temperature is called normal boiling point. If pressure is 1 bar then the boiling point is called
standard boiling point.
c) Viscosity.
It is well known that all liquids do not flow with the same speed. Some liquids like water, alcohol, ether etc., flow very rapidly, while someone like glycerine, honey, castor oil etc., flow slowly. This indicates that every liquid has some internal resistance to flow. This internal resistance to flow possessed by a liquid is called its viscosity.
Liquids which flow rapidly have low internal resistance. So their viscosity is less. Liquids which flow slowly have high internal resistance. So their viscosity is high.
Coefficient of viscosity is the ‘force per unit area required to maintain unit difference of velocity between two parallel layers in the liquid, one unit apart’.
Units : Dyne cm-2 (C.G.S) or Poise.
Millipoise = 10-3 Poise.
Ns m-2 or Pa s (pascal second) is S.I. unit.
Examples:
1) Glass is not a solid. It is a super-cooled liquid with a very high viscosity.
2) H2SO4 is viscous, due to H – bonding.
Viscosity of liquids decreases as the temperature rises because at high temperature molecules have high kinetic energy and can overcome the intermolecular forces to slip past one another between layers.
Problems
Question 1.
What will be the minimum pressure required to compress 500 dm3 of air at 1 bar to 200 dm³ at 30°C ?
Solution:
p1 = 1 bar, p2 = ?, V1 = 500 dm³, V2 = 200 dm³
According to Boyle’s law, P1V1 = p2V2
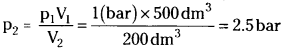

Question 2.
A vessel of 120 mL capacity contains a certain amount of gas at 35°C and 1.2 bar pressure. The gas is transferred to another vessel of volume 180 mL at 35°C. What would be its pressure ?
Solution:
p1 = 1.2 bar, p2 = ?, V1 = 120 mL, V2 = 180 mL
According to Boyle’s law, p1V1 = p2V2
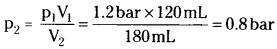
Question 3.
Using the equation of state pV = nRT, show that at a given temperature density of a gas is proportional to gas pressure p.
Solution:
Equation of state,
pV = nRT
p = pressure of gas
V = volume of gas
n = number of moles of gas
R = gas constant
T = Absolute temperature of gas
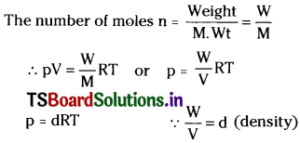
Since R and T are constant, p ∝ d
Question 4.
At 0°C, the density of a certain oxide of a gas at 2 bar is same as that of dinitrogen at 5 bar. What is the molecular mass of the oxide?
Solution:
Calculation of density of N2 at 5 bar and 0°C

Question 5.
Pressure of lg of an ideal gas A at 27°C is found to be 2 bar. When 2g of another ideal gas B is introduced in the same flask at same temperature the pressure becomes 3 bar. Find a relationship between their molecular masses.
Solution:
Ideal gas equation, pV = nRT or pV = \(\frac{W}{M}\)RT

Question 6.
The drain cleaner, Drainex contains small bits of aluminium which react with caustic soda to produce dihydrogen. What volume of dihydrogen at 20°C and one bar will be released when 0.15g of aluminium reacts?
Solution:
The chemical reaction taking place is

54 g of A1 produces hydrogen = 3 mol
0.15 g of A1 produces hydrogen
= \(\frac{3\times0.15}{54}\)mol = 8.33 × 10-3 mol.
Calculation of volume of 8.33 × 10-3 mol of hydrogen at 20°C and 1 bar.
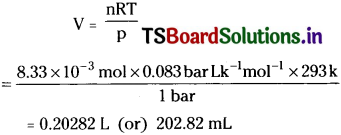
Question 7.
What will be the pressure exerted by a mixture of 3.2 g of methane and 4.4 g of carbon dioxide contained in a 9 dm flask at 27°C?
Solution:
Moles of methane = \(\frac{W}{M}=\frac{3.6}{16}\) = 0.2
Moles of H9 = \(\frac{W}{M}=\frac{4.4}{44}\) = 0.1
Total moles of CH4 and H2 = 0.2 + 0.1 = 0.3 nRT
Ideal gas equation, p = \(\frac{nRT}{V}\)
Pressure of the gaseous mixture,
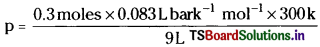
p = 0.83 bar
1 bar = 1.013 × 105 Pascal
0.83 bar = 0.83 × 1.013 × 105 = 8.31 × 104 Pascal.
Question 8.
What will be pressure of the gaseous mixture when 0.5 L of H2 at 0.8 bar and 2.0 L of dioxygen at 0.7 bar are introduced in a 1 L vessel at 27°C?
Solution:

Question 9.
Density of a gas is found to be 5.46 g/dm³ at 27°C at 2 bar pressure. What will be its density at STP?
Solution:
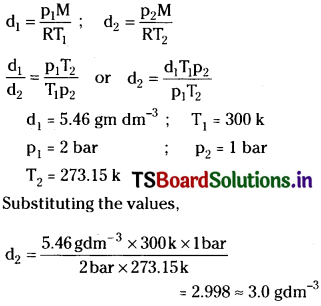
Question 10.
34.05 mL of phosphorus vapour weighs 0.0625 g at 546 °C and 0.1 bar pressure. What is the molar mass of phosphorus?
Solution:

Question 11.
A student forgot to add the reaction mixture to the round bottomed flask at 27°C but instead, he/she placed the flask on the flame. After a lapse of time, he realized his mistake, and using a pyrometer he found the temperature of the flask was 477 °C. What fraction of air would have been expelled out?
Solution:
Let the volume of flask be VmL
T1 = 27 + 273 = 300 k
T2 = 477 + 273 = 750 k
According to Charles’ law,

Question 12.
Calculate the temperature of 4.0 mol of a gas occupying 5 dm³ at 3.32 bar. (R = 0.083 bar dm³ K-1 mol-1).
Solution:

Question 13.
Calculate the total number of electrons present in 1.4 g of dinitrogen gas.
Solution:
Each N2 molecule contain 14 electrons.
Number of N2 molecules
= \(\frac{1.4}{28}\) × 6.023 × 1023
Number of electrons
= \(\frac{1.4}{28}\) × 6.023 × 1023 × 14 = 4.215 × 1023

Question 14.
How much time would it take to distribute one Avogadro number of wheat grains, if 1010 grains are distributed each second?
Solution:
1010 wheat grains are distributed in 1 sec.
6 × 1023 wheat grains can be distributed in
= \(\frac{6\times10^{23}}{10^{10}}\) = 6 × 1013sec. = 1.909 × 106 years.
Question 15.
Ammonia gas diffuses through a fine hole at the rate 0.5 lit min-1. Under the same conditions find the rate of diffusion of chlorine gas.
Solution:
For two gases the rates of diffusion is related to molecular weights as follows

Question 16.
Find the relative rates of diffusion of CO2 and Cl2 gases.
Solution:
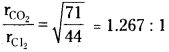
Question 17.
If 150 mL carbon monoxide effused in 25 seconds, what volume of methane would effuse in same time.
Solution:
The rate of effusion of carbon monoxide r1 = \(\frac{150mL}{25s}\)
The rate of effusion of methane, r2 = \(\frac{x mL}{25s}\)
According to Graham s law of diffusion,
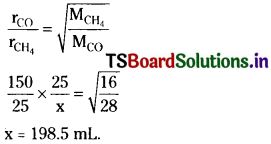
∴ In 25 seconds the volume of methane diffused = 198.5 mL.
Question 18.
Hydrogen chloride gas is sent into a 100 metre tube from one end ’A’ and ammonia gas from the other end ‘B’, under similar conditions. At what distant from ‘A’ will be the two gases meet.
Solution:
Let distance travelled by, HCl = x
Then the distance travelled by, NH3 = 100 – x
According to Graham s law,
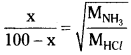

The two gases will meet at 40.48 metres from the end A.
Question 19.
Calculate the total pressure in a mixture of 8 g of dioxygen and 4 g of dihydrogen confined in a vessel of 1 dm³ at 27°C. R = 0.083 bar dm³ K-1 mol-1.
Solution:
Number of moles of H2 = \(\frac{4}{2}\) = 2.0 mol.
Number of moles of O2 = \(\frac{8}{16}\) = 0.5 mol.
Total number moles of gaseous mixture = 2.0 + 0.5 = 2.5 rtiol.
Ideal gas equation pV = nRT nRT


Question 20.
Calculate the total pressure in a mixture of 3.5 g of dinitrogen 3.0 g of dihydrogen and 8.0 g dioxygen confined in vessel of 5 dm³ at 27°C (R = 0.083 bar dm³ K-1 mol-1).
Solution:
Number of moles of N2 = \(\frac{3.5}{28}\) = 0.125
Number of moles of H2 = \(\frac{3.0}{2}\) = 1.5
Number of moles of O2 = \(\frac{8.0}{32}\) = 0.25
Total number moles of gaseous mixture
= 0.125 + 1.5 + 0.25 = 1.875
Substituting these values in ideal gas equation

Question 21.
Pay load is defined as the difference between the mass of displaced air and the mass of the balloon. Calculate the pay load when a balloon of radius 10 m, mass 100 kg is filled with helium at 1.66barat27°C. (Density of air =1.2 kg m-3 and R = 0.083 bar dm³ K-1 mol-1).
Solution:
Volume of balloon = \(\frac{4}{3}\)πr³ = \(\frac{4}{3}\)π(10)³ = 4190.47 m³
Weight of air = dV = 5028.5 kg
Moles of He = \(\frac{pV}{RT}\)
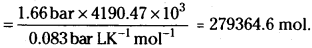
Weight of He = 279364.6 × 4 = 1117450 g
= 1117.45 kg
Pay load = Weight of air – Weight of He – Weight of balloon
= 5028.5-1117.45-100 = 3811.1 kg
Question 22.
Calculate the volume occupied by 8.8 g of C02 at 31.1°C and 1 bar pressure, R = 0.083 bar LK-1mol-1.
Solution:
Moles of CO2, n = \(\frac{8.8}{44}\) = 0.2
R = 0.083 bar LK-1mol-1
T = 273 + 31.1 = 304.1 K
P = 1 bar
Substituting these values in ideal gas equation

Question 23.
2.9 g of a gas at 95°C occupied the same volume as 0.184 g of dihydrogen at 17°C, at the same pressure. What is the molar mass of the gas?
Solution:
For unknown gas
V1 = V

Question 24.
A mixture of dihydrogen and dioxygen at one bar pressure contains 20% by weight of dihydrogen. Calculate the partial pressure of dihydrogen.
Solution:
The percent of H2 = 20
∴ The percent of O2 = 80
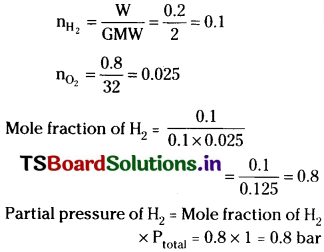
Question 25.
What would be the SI unit for the quantity pV²T²/n?
Solution:
Ideal gas equation pV = nRT
p = \(\frac{nRT}{V}\)
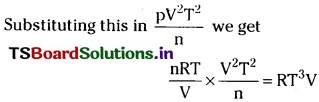
S.I. unit Joule m³ deg K² mol-1

Question 26.
In terms of Charles’ law explain why – 273°C is the lowest possible temperature.
Solution:
Charles found that for all gases at any given pressure, graph of volume Vs temperature (in celcius, is a straight line intercepts the temperature axis at – 273.15°C. At zero volume all the lines at different pressures meet at the temperature axis at – 273.15°. At this temperature, no gas exist. This is the hypothetical or imaginary temperature at which gases are supposed to occupy zero volume. So it is considered the lowest possible temperature.
Question 27.
Critical temperature for carbon dioxide and methane are 31.1°C and – 81.9°C respectively. Which of these has stronger intermolecular forces and why?
Solution:
If the critical temperature of a gas is more the intermolecular forces are strong and can be converted easily into liquid.
Since the critical temperature of CO2 (31.1°C) is more than that of methane (- 81.9°C), the intermolecular forces in CO2 are stronger.
Question 28.
Air is cooled form 25°C to 0°C. Calculate the decrease in rms speed of the molecules.
Solution:

Question 29.
Find the rms, most probable and average speeds of SO2 at 27°C.
Solution:

Question 30.
Find the RMS, average and most probable speeds of O2 at 27°C.
Answer:

Additional Questions & Answers
Question 1.
A balloon is filled with hydrogen at room temperature. It will burst if pressure exceeds 0.2 bar. If at 1 bar pressure the gas occupies 2.27 L volume, upto what volume can the balloon be expanded?
Answer:
According to Boyle’s Law p1V1 = p2V2
if p1 is 1 bar, V1 will be 2.27L

Since balloon bursts at 0.2 bar pressure,the volume of balloon should be less than 11.35 L.
Question 2.
On a ship sailing in pacific ocean where temperature is 23.4 °C, a balloon is filled with 2 L air. What will be the volume of the balloon when the ship reaches Indian ocean, where temperature is 26.1°C?
Answer:
V1 = 2L
T1 = (23.4+273)K = 296.4 K
T2 = 26.1+ 273 = 299.1 K
From Charles law

Question 3.
At 25°C and 760 mm of Hg pressure, a gas occupies 600 mL volume. What will be its pressure at a height where temperature is 10°C and volume of the gas is 640 mL.
Answer:
p1 = 760 mm Hg, V1 = 600 mL
T1 = 25 + 273 = 298 K
V2 = 640 mL and T2 = 10 + 273 = 283K
According to Combined gas law
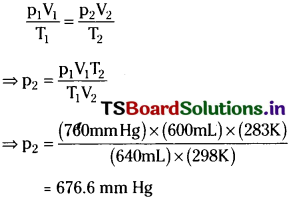
Question 4.
360 cm³ of CH4 gas diffused through a porous membrane in 15 minutes. Under similar conditions, 120 cm³ of another gas diffused in 10 minutes. Find the molar mass of the gas. [Mar. ’18 (AP)]
Answer:
Methane
Rate of diffusion of methane

Molar mas of unknown gas (M2) = ?
According to Graham s law of diffusion,

Molar mass of the unknown gas = 64 g.mol-1

Question 5.
Carbon di oxide and another gas ‘X’ have their rates of diffusion as 0.299cc s-1 and 0.271 cc s-1 respectively. Find the vapour density of the gas ‘X’, if the vapour density of carbon di oxide is 22.
Answer:
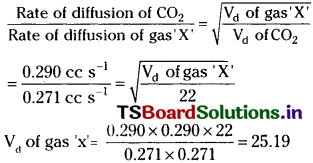
Question 6.
A neon-dioxygen mixture contains 70.6 g dioxygen and 167.5 g neon. If pressure of the mixture of gases in the cylinder is 25 bar. What is the partial pressure of dioxygen and neon in the mixture?
Answer:

Alternatively,
mole fraction of neon = 1 – 0.21 = 0.79
Partial pressure = mole fraction × total pressure
⇒ Partial pressure of oxygen
= 0.21 × (25 bar) = 5.25 bar
Partial pressure of neon
= 0.79 × (25 bar) = 19.75 bar
Question 7.
Find RMS speed, average speed and most probable speed of C02 gas at 27°C.
Answer:
T = 27 + 273 = 330 K ;
R = 8.314 J mol-1K-1
M = Gram molecular mass of CO2 = 44g mob-1.
RMS speed (urms) = urms = \(\sqrt{\frac{3RT}{M}}\)
T = 27°C + 273 = 300 K ; R = 8.314 J mob-1 K-1
M = gram molecular mass of CO2 = 44 g mol-1
(1J = Kg m² s-2)

Average speed (uav) = 0.9123 × RMS speed
= 0.9212 × 4.12 × 10²m s-1
= 3.8 × 10²m s-1
Most probable speed
(ump) = 0.8166 × 4.12 × 10²m s-1
= 3.36 × 10²m s-1
Question 8.
Calculate kinetic energy of 5 moles of Nitrogen at 27°C.
Answer:
Kinetic energy = \(\frac{3}{2}\) nRT
where n = 5 moles ; R = 8.314 mol-1 k-1
T = 27°C + 273 = 300k
Kinetic energy
Ek = \(\frac{3}{2}\) × 5 mol × 8.314 J mol-1 K-1 × 300 K
= 18706.50 J

Question 9.
Calculate kinetic energy (in SI units) of 4g. of methane at -73°C. [TS Mar. ’19]
Answer:
n= No of moles of methane
\(\frac{4g}{16gmol^1}\) = 0.25 mol
R = 8.314 J mob-1 K-1
T = – 73°C + 273 = 200 K Kinetic energy
= \(\frac{3}{2}\) × 0.25 mol × 8.314 J mob-1 K-1 × 200 K = 623.6 J
Question 10.
Calculate the ratio of kinetic energies of 3g of Hydrogen and 4g of Oxygen at a given temperature. [AP Mar. ’19; (TS ’16)]
Answer:
Since the temperature is same for the two gases, we can write the ratio of kinetic energies is in the moles of H2: moles of O2
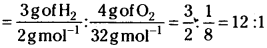
![]()
![]()

![]()
![]()
![]()