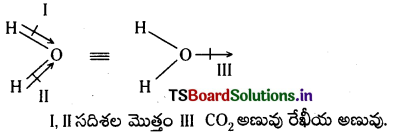
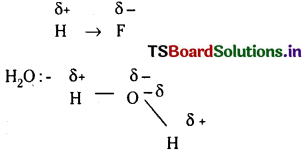
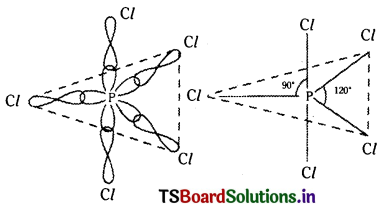
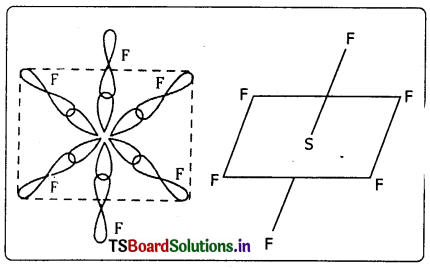
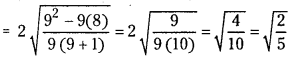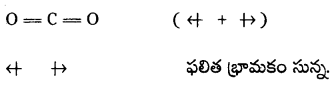Telangana TSBIE TS Inter 1st Year Chemistry Study Material 4th Lesson పదార్ధం స్థితులు : వాయువులు, ద్రవాలు Textbook Questions and Answers.
TS Inter 1st Year Chemistry Study Material 4th Lesson పదార్ధం స్థితులు : వాయువులు, ద్రవాలు
అత్యంత లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 1.
వాయు అణువుల మధ్య ఉండే వివిధ రకాల అంతర అణుబలాలను పేర్కొనండి.
జవాబు:
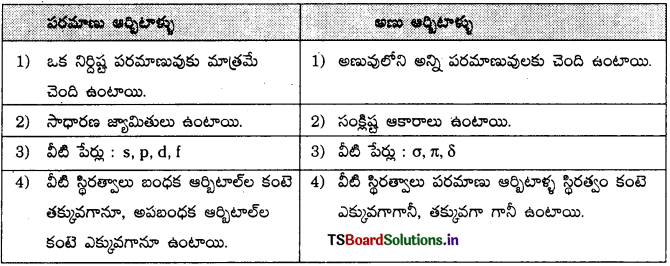
ఒక పదార్థంలోని కణాలైన పరమాణువులు లేదా అణువుల మధ్య ఉండే ఆకర్షణ, వికర్షణ బలాలను అంతర అణు బలాలు అంటారు. అంతర అణు ఆకర్షణ బలాలను వాండర్ వాల్స్ బలాలు అంటారు.
- విక్షేపణ బలాలు లేదా లండన్ బలాలు : రెండు తాత్కాలిక ద్విధ్రువాల మధ్య ఉండే ఆకర్షణ బలాలను లండన్ బలాలు లేదా విక్షేపణ బలాలు అంటారు.
- ద్విధ్రువ ద్విధ్రువ ఆకర్షణ బలాలు : శాశ్వత ద్విధ్రువాల మధ్య ఉండే బలాలను ద్విధ్రువ-ద్విధ్రువ బలాలు అంటారు.
- ద్విధ్రువ – ప్రేరిత ద్విధ్రువ బలాలు : ఈ బలాలు శాశ్వత ద్విధ్రువ భ్రామకం ఉన్న అణువుకు శాశ్వత ద్విధ్రువ భ్రామకంలేని అణువులకు మధ్య ఉత్పన్నమవుతాయి.
- హైడ్రోజన్ బంధం : ఒక ప్రత్యేకమైన ద్విధృవ-ద్విధృవ ఆకర్షణ బలం.
ప్రశ్న 2.
బాయిల్ నియమాన్ని తెలిపి, దాని గణితాత్మక రూపం తెలపండి.
జవాబు:
బాయిల్ సూత్రం : స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశిగల వాయువు యొక్క ఘనపరిమాణం దాని పీడనానికి విలోమానుపాతంలో ఉంటుంది. దీనిని గణితాత్మకంగా ఈ క్రింది విధంగా రాస్తారు.
V ∝ \(\frac{1}{P}\) = (స్థిర ఉష్ణోగ్రత) లేక V = \(\frac{K}{P}\) (స్థిర ఉష్ణోగ్రత) లేక PV = K (స్థిరం)

ప్రశ్న 3.
ఛార్లెస్ నియమాన్ని తెలిపి, దాని గణితాత్మక రూపం తెలపండి.
జవాబు:
ఛార్లెస్ సూత్రం : స్థిర పీడనం వద్ద నియమిత ద్రవ్యరాశి గల వాయువు యొక్క ఘనపరిమాణం దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది. దీనిని గణితాత్మకంగా ఈ క్రింది విధంగా రాస్తారు.
V ∝ T (స్థిరపీడనం) లేక V = K × T (స్థిరపీడనం) లేక = \(\frac{\mathrm{V}}{\mathrm{T}}\) = K (స్థిరం)
ప్రశ్న 4.
సమోష్ణోగ్రతరేఖలు అంటే ఏమిటి ?
జవాబు:
స్థిర ఉష్ణోగ్రత వద్ద పీడనానికి, ఘనపరిమాణానికి మధ్యగల సంబంధాన్ని తెలియజేసే వక్రాలను సమోష్ణోగ్రతరేఖలు అంటారు.
ప్రశ్న 5.
పరమ ఉష్ణోగ్రత అంటే ఏమిటి ?
జవాబు:
-273.15°C ఉష్ణోగ్రతను 0° గా తీసికొని ఏర్పరచిన ఉష్ణోగ్రతమాలను పరమ ఉష్ణోగ్రత అందురు. (కెల్విన్ ఉష్ణోగ్రత అందురు). సెంటీగ్రేడ్ ఉష్ణోగ్రత + 273.15 = కెల్విన్ ఉష్ణోగ్రత. కెల్విన్ ఉష్ణోగ్రత – 273.15 = సెంటీ గ్రేడ్ ఉష్ణోగ్రత. -273.15°C ను పరమశూన్య ఉష్ణోగ్రత అందురు. దీనిని oK గా సూచిస్తారు.
ప్రశ్న 6.
సమపీడన రేఖలు అంటే ఏమిటి ?
జవాబు:
స్థిర పీడనం వద్ద వాయువు ఘనపరిమాణానికి, ఉష్ణోగ్రతకు మధ్యగల సంబంధాన్ని తెలియజేసే వక్రాలను సమపీడన రేఖలు అంటారు.
ప్రశ్న 7.
పరమశూన్య ఉష్ణోగ్రత అంటే ఏమిటి ?
జవాబు:
-273.15°C ఉష్ణోగ్రతను పరమశూన్య ఉష్ణోగ్రత అంటారు. దీనిని కెల్విన్మానంలో 0K గా సూచిస్తారు. పరమశూన్య ఉష్ణోగ్రత వద్ద వాయు అణువుల కదలిక ఆగిపోయి వాయువు యొక్క గతిజశక్తి శూన్యం అవుతుంది.
ప్రశ్న 8.
అవొగాడ్రో నియమాన్ని తెలపండి.
జవాబు:
అవొగాడ్రోనియమం: ఒకే ఉష్ణోగ్రత పీడన పరిస్థితులవద్ద సమాన ఘనపరిమాణములున్న విభిన్న వాయువులు సమాన సంఖ్యలో అణువులను కలిగి ఉంటాయి. V ∝ n (P, T లు స్థిరం) లేక V = K × n (P, T లు స్థిరం) లేక \(\frac{\mathrm{V}}{\mathrm{n}}\) = K స్థిరం

ప్రశ్న 9.
స్థిర ఘనపరిమాణ రేఖలు అంటే ఏమిటి ?
జవాబు:
స్థిర మోలార్ ఘనపరిమాణంగల వాయువు పీడన – ఉష్ణోగ్రతా రేఖలను స్థిర ఘనపరిమాణ రేఖలు అంటారు లేదా ‘ఐసోకోర్లు’ అంటారు.
ప్రశ్న 10.
STP పరిస్థితులను తెలపండి.
జవాబు:
273.15K ఉష్ణోగ్రత, 1 bar (105 పాస్కల్) పీడనంలను ప్రమాణ ఉష్ణోగ్రత, పీడనాలు అంటారు.
ప్రశ్న 11.
గ్రామ్ మోలార్ ఘనపరిమాణం అంటే ఏమిటి ?
జవాబు:
ఒక మోల్ వాయువు STP వద్ద 22.71098 లీటర్ల ఘనపరిమాణమును ఆక్రమిస్తుంది. దీనినే గ్రామ్ మోలార్ ఘన పరిమాణం అంటారు.
ప్రశ్న 12.
ఆదర్శవాయువు అంటే ఏమిటి ?
జవాబు:
అన్ని ఉష్ణోగ్రతలు మరియు పీడనాల వద్ద వాయు నియమాలను పాటించే వాయువులను ఆదర్శవాయువులు అంటారు.
ఆదర్శవాయువులకు PV = nRT.
ప్రశ్న 13.
వాయు స్థిరాంకం ‘R’ ను విశ్వవాయు స్థిరాంకం అని ఎందుకు పిలుస్తారు ?
జవాబు:
‘R’ విలువ అన్ని వాయువులకు వర్తిస్తుంది. అన్ని వాయువులకు ‘R’ విలువ సమానం. అందువల్ల R ను విశ్వవాయు స్థిరాంకం అంటారు.
ప్రశ్న 14.
ఆదర్శవాయు సమీకరణాన్ని స్థితి సమీకరణం అని ఎందుకు అంటారు ?
జవాబు:
వాయువు యొక్క కొలవదగిన ధర్మాలైన P, V, T మరియు n ల మధ్య సంబంధాన్ని ఆదర్శవాయు సమీకరణం తెలియజేస్తుంది. అది వాయువు యొక్క స్థితిని వర్ణిస్తుంది. కనుక దానిని స్థితి సమీకరణం అంటారు.
ప్రశ్న 15.
వాయు స్థిరాంకం ‘R’ విలువను వివిధ ప్రమాణాల్లో తెలపండి.
జవాబు:
R = 8.20578 × 10-2 L. atm K-1 mol-1
R = 8.314 JK-1 mol-1
ప్రశ్న 16.
ఒక వాయువు యొక్క సాంద్రత, మోలార్ ద్రవ్యరాశుల మధ్య సంబంధాన్ని తెలపండి.
జవాబు:
మోలార్ ద్రవ్యరాశి M = \(\frac{\mathrm{dRT}}{\mathrm{P}}\)
M = మోలార్ ద్రవ్యరాశి,
R = వాయు స్థిరాంకం,
P = పీడనం,
d = వాయు సాంద్రత,
T = పరమ ఉష్ణోగ్రత
ప్రశ్న 17.
గ్రాహం వాయు వ్యాపన నియమాన్ని తెలపండి.
జవాబు:
స్థిర ఉష్ణోగ్రత, పీడనాల వద్ద ఒక వాయువు యొక్క వ్యాపన రేటు దాని సాంద్రత లేక బాష్ప సాంద్రత లేక అణుభారాల వర్గమూలానికి విలోమానుపాతంలో ఉంటుంది.
వాయు వ్యాపన రేటు r ∝ \(\frac{1}{\sqrt{\mathrm{d}}}\)
r ∝ \(\frac{1}{\sqrt{m}}\)
ప్రశ్న 18.
N2, O2, CH4 వాయువులలో ఏది త్వరితంగా వ్యాపనం చెందుతుంది. ఎందువల్ల ?
జవాబు:
CH4 (మీథేన్) త్వరితంగా వ్యాపనం చెందుతుంది. ఎందువలన అంటే N2, O2 కంటే అది తేలికైనది.
ప్రశ్న 19.
సల్ఫర్ డయాక్సైడ్ కంటే మీథేన్ ఎన్ని రెట్లు త్వరితంగా వ్యాపనం చెందుతుంది ?
జవాబు:

సల్ఫర్ డయాక్సైడ్ కంటే మీథేన్ రెండు రెట్లు త్వరితంగా వ్యాపనం చెందుతుంది.
ప్రశ్న 20.
డాల్టన్ పాక్షిక పీడనాల నియమాన్ని తెలపండి.
జవాబు:
డాల్టన్ పాక్షిక పీడనాల నియమం : స్థిర ఉష్ణోగ్రత వద్ద రసాయనికంగా చర్య జరపని వాయు మిశ్రమం కలుగజేసే మొత్తం పీడనం, అందులోని అనుఘటక వాయువుల పాక్షిక పీడనాల మొత్తానికి సమానము. P = P1 + P2 + P3
ప్రశ్న 21.
ఒక వాయువు పాక్షిక పీడనానికి, దాని మోల్ భాగానికి గల సంబంధాన్ని తెలపండి.
జవాబు:
పాక్షిక పీడనం = వాయు మిశ్రమం మొత్తం పీడనం × మోల్ భాగం
P1 = P × x1
P2 = P × x2
ప్రశ్న 22.
నీటి ఆవిరి సంతృప్త బాష్పపీడనం అంటే ఏమిటి ?
జవాబు:
నియమిత ఉష్ణోగ్రత వద్ద, నీటి ఆవిరి అణువులు ద్రవ నీటితో సమతాస్థితిలో ఉన్నప్పుడు, ద్రవనీటి ఉపరితలంపై నీటి ఆవిరి అణువులు కలుగజేసే పీడనాన్ని నీటి ఆవిరి సంతృప్త బాష్పపీడనం అంటారు.
ప్రశ్న 23.
వాయువుల అణుచలన సిద్ధాంతంలోని ఏ రెండు అంశాలు ఆదర్శ ప్రవర్తన నుంచి నిజవాయువుల విచలనాన్ని వివరించలేవు?
జవాబు:
- వాయువు ఆక్రమించే మొత్తం ఘనపరిమాణంతో పోలిస్తే వాయు అణువులు తమంతట తాము ఆక్రమించే ఘనపరిమాణంను నిర్లక్ష్యం చేయవచ్చు.
- వాయు అణువుల మధ్య ఆకర్షణ వికర్షణ బలాలు లేవు.

ప్రశ్న 24.
చలద్వాయు సమీకరణాన్ని వ్రాసి, దానిలోని పదాలను తెలపండి.
జవాబు:
pV = \(\frac{1}{3} \mathrm{mn} \mathrm{u}_{\mathrm{rms}}^2\)
p = పీడనం,
V = ఘనపరిమాణం,
m = వాయు అణువు ద్రవ్యరాశి,
n = వాయు అణువుల సంఖ్య,
urms = వాయు అణువుల RMS వేగం.
ప్రశ్న 25.
వాయు అణువుల గతిజశక్తిని లెక్కకట్టుటకు సమీకరణాన్ని తెలపండి.
జవాబు:
వాయు అణువుల సగటు గతిజశక్తి
Ek = \(\frac{3}{2}\)nRT
n = మోల్ల సంఖ్య
R = వాయు స్థిరాంకం
T = పరమ ఉష్ణోగ్రత
ఒక అణువు గతిజశక్తి Ek = \(\frac{3}{2}\)kT
k = బోల్ట్స్మన్ స్థిరాంకం
k = \(\frac{R}{N}\); N = అవగాడ్రో సంఖ్య
ప్రశ్న 26.
బోల్ట్స్మన్ స్థిరాంకం అంటే ఏమిటి ? దాని విలువను తెలపండి.
జవాబు:
ఒక వాయు అణువు యొక్క స్థిరాంకాన్ని బోల్ట్స్మన్ స్థిరాంకం అంటారు.
k = \(\frac{\mathrm{R}}{\mathrm{N}}\)
k = 1.38 × 10-23 JK-1 molecule-1 (or) 1.38 × 10-16 erg K-1 molecule-1
ప్రశ్న 27.
RMS వేగం అంటే ఏమిటి ?
జవాబు:
వాయు అణువుల వేగ వర్గాల సగటు యొక్క వర్గ మూలం, వాయు అణువుల వేగాలు u1, u2, u3 ……. అయితే

n = వాయు అణువుల సంఖ్య, Urms = \(\sqrt{\frac{3 R T}{M}}\)
ప్రశ్న 28.
సగటు వేగం అంటే ఏమిటి ?
జవాబు:
n వాయు అణువుల వేగాలు u1, u2, u3 అయితే సరాసరి వేగం

ప్రశ్న 29.
గరిష్ఠ సంభావ్యత వేగం అంటే ఏమిటి ?
జవాబు:
గరిష్ఠ సంఖ్య అణువులకు గల వేగాన్ని గరిష్ఠ సంభావ్యత వేగం అంటారు.
Ump = \(\sqrt{\frac{2 \mathrm{RT}}{\mathrm{M}}}\)
M = అణుభారం,
T = పరమ ఉష్ణోగ్రత
ప్రశ్న 30.
వాయు అణువుల వేగాలపై ఉష్ణోగ్రత ప్రభావమేమిటి ?
జవాబు:
వాయు అణువుల వేగం పెరుగుతుంది. అణువుల వేగాల పంపిణీ ప్రకారం, తక్కువ వేగాలు గల అణుభాగం ఉష్ణోగ్రత పెరిగితే తగ్గుతుంది. అదే విధంగా ఎక్కువ వేగాలు గల అణువుల భాగం పెరుగుతుంది.
ప్రశ్న 31.
వాయు అణువుల గతిజశక్తిపై ఉష్ణోగ్రత ప్రభావమేమిటి ?
జవాబు:
వాయు అణువుల గతిజశక్తి Ek = \(\frac{3}{2}\)nRT
∴ Ek ∝ T
వాయు అణువుల గతిజశక్తి పరమ ఉష్ణోగ్రతకు అనుపాతంలో ఉంటుంది. ఉష్ణోగ్రత పెరిగితే అణువుల గతిజశక్తి పెరుగుతుంది.
ప్రశ్న 32.
వాయు అణువుల RMS వేగం, సగటు వేగం, గరిష్ఠ సంభావ్యత వేగాల నిష్పత్తిని తెలపండి.
జవాబు:
Ump : Uav : Urms = 1 : 1.128 : 1.224
ప్రశ్న 33.
చలద్వాయు సమీకరణంలో RMS వేగాన్ని ఎందుకు తీసుకుంటారు ?
జవాబు:
వేగం అనేది సదిశరాశి. వాయు అణువులు నిరంతరం అన్ని దిశలలో క్రమ రాహిత్యంగా తిరుగుతూ ఉంటాయి. ఒక దిశలో వేగాన్ని ధనాత్మకంగా తీసికొంటే దానికి వ్యతిరేక దిశలో వేగం ఋణాత్మకం అవుతుంది. ఈ పరిస్థితులలో సరాసరి వేగం విలువ సున్న అయ్యే అవకాశం ఉంది. దానిని నివారించడానికి అన్ని వేగాలను వర్గం చేసి వాటి సరాసరిని కనుగొని ఆ సరాసరి విలువకు వర్గమూలాన్ని తీసుకున్నారు. అపుడు అది నిజమైన సరాసరి వేగం అవుతుంది. దీనినే RMS వేగం అంటారు.
RMS వేగం = urms = \(\sqrt{\frac{u_1^2+u_2^2+u_3^2+\ldots \ldots . u_n^2}{n}}\)
ప్రశ్న 34.
సంపీడన గుణకం అంటే ఏమిటి ?
జవాబు:
ఒకే ఉష్ణోగ్రతా పీడన పరిస్థితుల వద్ద నిజవాయువు మోలార్ ఘనపరిమాణాలకు ఆదర్శవాయు మోలార్ ఘనపరిమాణాలకు గల నిష్పత్తిని సంపీడన గుణకం అంటారు.

ఆదర్శ వాయువుకు Z = 1
ప్రశ్న 35.
బాయిల్ ఉష్ణోగ్రత అంటే ఏమిటి ?
జవాబు:
విస్తృత పీడనాల్లో ఏ ఉష్ణోగ్రత వద్దనైతే నిజవాయువు ఆదర్శ వాయు నియమాన్ని పాటిస్తుందో ఆ ఉష్ణోగ్రతను బాయిల్ ఉష్ణోగ్రత అంటారు. ఈ ఉష్ణోగ్రత వాయువు స్వభావం మీద ఆధారపడి ఉంటుంది.
ప్రశ్న 36.
సందిగ్ధ ఉష్ణోగ్రత అంటే ఏమిటి ? CO2 కు దాని విలువ ఇవ్వండి.
జవాబు:
ఏ ఉష్ణోగ్రత కన్నా అధిక ఉష్ణోగ్రత వద్ద అధిక పీడనాన్ని ఉపయోగించినప్పటికి వాయువును ద్రవీకరింపచేయలేమో, ఆ ఉష్ణోగ్రతను సందిగ్ధ ఉష్ణోగ్రత అంటారు. వాయువును సందిగ్ధ ఉష్ణోగ్రత వద్దగాని, అంత కంటె తక్కువ ఉష్ణోగ్రత వద్ద గాని అధిక పీడనాన్ని ఉపయోగించి ద్రవీకరించవచ్చు. ఉదా : CO2, కు సందిగ్ధ ఉష్ణోగ్రత = 30.98°C

ప్రశ్న 37.
సందిగ్ధ ఘనపరిమాణం అంటే ఏమిటి ?
జవాబు:
సందిగ్ధ ఉష్ణోగ్రత, సందిగ్ధ పీడనాల వద్ద ఒక మోల్ వాయువు ఆక్రమించే ఘనపరిమాణాన్ని సందిగ్ధ ఘనపరిమాణం (Vc) అంటారు.
ప్రశ్న 38.
సందిగ్ధ పీడనం అంటే ఏమిటి ?
జవాబు:
వాయువును సందిగ్ధ ఉష్ణోగ్రత వద్ద ఉంచి, ద్రవీకరింపచేయడానికి ఉపయోగించవలసిన పీడనాన్ని సందిగ్ధ పీడనం అంటారు.
ప్రశ్న 39.
సందిగ్ధ స్థిరాంకాలు అంటే ఏమిటి ?
జవాబు:
సందిగ్ధ ఉష్ణోగ్రత, సందిగ్ధ పీడనం మరియు సందిగ్ధ ఘనపరిమాణంలను సందిగ్ధ స్థిరాంకాలు అంటారు. (Tc, Pc, Vc)
ప్రశ్న 40.
ద్రవం బాష్పపీడనాన్ని నిర్వచించండి.
జవాబు:
ద్రవ ఉపరితలంపై దాని బాష్పం కలుగచేయు పీడనాన్ని ద్రవ బాష్పపీడనం అంటారు.
ద్రవ, బాష్పాల మధ్య సమతాస్థితి ఉన్నప్పుడు, ద్రవంపై బాష్పం కలుగచేయు పీడనాన్ని సంతృప్త బాష్పపీడనం అంటారు.
ప్రశ్న 41.
సాధారణ, ప్రమాణ బాష్పీభవన ఉష్ణోగ్రతలు అంటే ఏమిటి ? H2O కు వాటి విలువలు ఇవ్వండి.
జవాబు:
పీడనం ‘1’ అట్మాస్ఫియర్ వద్ద ద్రవం మరిగే ఉష్ణోగ్రతను సాధారణ బాష్పీభవన స్థానం అంటారు. అదే 1 బార్ పీడనం వద్ద ద్రవం మరిగే ఉష్ణోగ్రతను ‘ప్రమాణ బాష్పీభవనస్థానం’ అంటారు.
నీటి సాధారణ బాష్పీభవన స్థానం 100°C. ప్రమాణ బాష్పీభవన స్థానం 99.6°C
ప్రశ్న 42.
కొండల మీద వంట చేయడానికి ప్రెజర్ కుక్కర్లను ఎందుకు వాడతారు ?
జవాబు:
ఎత్తు ప్రదేశాలలో వాతావరణ పీడనం తగ్గుతుంది. అందువల్ల ద్రవాల బాష్పీభవన స్థానాలు తగ్గుతాయి. కొండల మీద నీటి బాష్పీభవన స్థానం తక్కువగా ఉండుట వలన వంట చేయడానికి ప్రెజర్ కుక్కర్లను వాడతారు.
ప్రశ్న 43.
తలతన్యత అంటే ఏమిటి ?
జవాబు:
ద్రవాలు సాధ్యమైనంత తక్కువ ఉపరితల వైశాల్యం కలిగి ఉండేటట్లు ప్రయత్నిస్తాయి.
ద్రవం ఉపరితలంపై గీసిన రేఖకు లంబ దిశలో ఏకాంక పొడవుపై పనిచేసే బలాన్ని తలతన్యత అంటారు. ప్రమాణాలు Kg.S-2 లేదా SI ప్రమాణాల్లో Nm-1.
ప్రశ్న 44.
దళ ప్రవాహం అంటే ఏమిటి ?
జవాబు:
ఒక్కొక్క పొరలోని అణువులు వేరువేరు వేగాలతో ప్రయాణిస్తూ, ఒక క్రమపద్ధతిలో వేగాల్లో భేదాలున్న ఈ పొరల ప్రవాహాన్ని దళ ప్రవాహం అంటారు.
ప్రశ్న 45.
స్నిగ్ధతా గుణకం అంటే ఏమిటి ? దాని ప్రమాణాలు తెలపండి.
జవాబు:
ఏకాంక స్పర్శా వైశాల్యం, ఏకాంక వేగ ప్రవీణత గల ద్రవ ప్రవాహపు పొరపై పనిచేసే బలాన్ని స్నిగ్ధతా గుణకం అంటారు.
స్నిగ్ధతా గుణకం SI ప్రమాణాలు Ns m-2 CGS ప్రమాణాలు poise (పాయిస్)
1 పాయిస్ = 1 g cm-1 S-1
లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 46.
బాయిల్ నియమాన్ని తెలిపి, వివరించండి.
జవాబు:
స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశి గల వాయువు యొక్క ఘనపరిమాణం దాని పీడనానికి విలోమానుపాతంలో ఉంటుంది.
V ∝ \(\frac{1}{\mathrm{P}}\) (స్థిర ఉష్ణోగ్రత)
V = \(\frac{K}{P}\)
PV = K (స్థిరం)
నియమిత ద్రవ్యరాశిగల ఒక వాయువు ఘనపరిమాణం పీడనం P1 పీడనం వద్ద V1 అనుకొనుము. అదే విధంగా P2 పీడనం వద్ద ఘనపరిమాణం V2 అయితే
P1V1 = P2V2
దీనిలో నాలుగు పదాలున్నాయి. ఏ మూడు పదాలు తెలిసినా నాల్గవ పదాన్ని లెక్క కట్టవచ్చు.
ప్రశ్న 47.
ఛార్లెస్ నియమాన్ని తెలిపి, వివరించండి.
జవాబు:
స్థిరపీడనం వద్ద నియమిత ద్రవ్యరాశి గల వాయువు యొక్క ఘనపరిమాణము దాని పరమ ఉష్ణోగ్రతకు అనులోమాను- పాలో ఉంటుంది.
V ∝ T (స్థిర పీడనం)
V = KT
\(\frac{V}{T}\) = K లేక \(\frac{V}{T}\) = K
నియమిత ద్రవ్యరాశిగల వాయువు యొక్క ఘనపరిమాణం T1 ఉష్ణోగ్రత వద్ద V1 అని, T2 ఉష్ణోగ్రత వద్ద V2 అయితే
\(\frac{V_1}{T_1}\) = \(\frac{V_2}{T_2}\). దీనిలో నాలుగు పదాలున్నాయి. ఏ మూడు పదాలు తెలిసినా నాల్గవ పదాన్ని లెక్కకట్టవచ్చు.
ప్రశ్న 48.
ఆదర్శ వాయు సమీకరణాన్ని ఉత్పాదించండి.
జవాబు:
ఆదర్శ వాయు సమీకరణం రాబట్టుట : బాయిల్, ఛార్లెస్ మరియు అవగాడ్రో సూత్రాలను కలిపి వ్రాస్తే ఘనపరిమాణము, పీడనం, పరమ ఉష్ణోగ్రత మరియు మోల్ల సంఖ్యలకు గల సంబంధాన్ని తెలియచేసే సమీకరణం వస్తుంది. దీనినే ఆదర్శ వాయు సమీకరణం అంటారు.
V ∝ \(\frac{1}{p}\) (T స్థిరం) బాయిల్ సూత్రం
V ∝ T(p స్థిరం) ఛార్లెస్ సూత్రం
V ∝ n (p, T లు స్థిరం) అవొగాడ్రో సూత్రం
పై మూడు సూత్రాలను కలిపి వ్రాస్తే
V ∝ \(\frac{1}{p}\) × T × n లేక V = R × \(\frac{1}{p}\) × T × n లేక pV = nRT
దీనినే ఆదర్శవాయు సమీకరణం అంటారు. దీనిలో p = పీడనం, V = ఘనపరిమాణము n = మోల్ల సంఖ్య, T = పరమ ఉష్ణోగ్రత, R = సార్వత్రిక వాయు స్థిరాంకం.
p1 పీడనం, T1 పరమ ఉష్ణోగ్రతల వద్ద ఒక వాయువు ఘనపరిమాణము V1 అని అనుకొనుము. అదే విధంగా p2 పీడనం, T2 పరమ ఉష్ణోగ్రతల వద్ద అదే వాయువు ఘనపరిమాణము V2 అని అనుకొనుము.
అపుడు \(\frac{\mathrm{p}_1 \mathrm{~V}_1}{\mathrm{~T}_1}\) = R మరియు \(\frac{\mathrm{p}_2 \mathrm{v}_2}{\mathrm{~T}_2}\) = R
∴ \(\frac{\mathrm{p}_1 \mathrm{~V}_1}{\mathrm{~T}_1}\) = \(\frac{\mathrm{p}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
దీనిలో ఆరు పదాలు ఉన్నాయి. ఏ ఐదు పదాలు తెలిసినా ఆరవ పదాన్ని లెక్కగట్టవచ్చును.
ప్రశ్న 49.
గ్రాహం వాయు వ్యాపన నియమాన్ని తెలిపి, వివరించండి.
జవాబు:
స్థిర ఉష్ణోగ్రత, పీడన పరిస్థితుల వద్ద, ఒక వాయువు యొక్క వ్యాపన రేటు దాని సాంద్రత లేక బాష్ప సాంద్రత లేక అణుభారాల వర్గమూలానికి విలోమానుపాతంలో ఉంటుంది.

రెండు వాయువుల వ్యాపన రేట్లు వరుసగా r1, r2 లు అని, వాటి సాంద్రతలు d1, d2 లు అని అనుకుంటే
అపుడు, \(\frac{r_1}{r_2}\) = \(\sqrt{\frac{\mathrm{d}_2}{\mathrm{~d}_1}}\) …….. (1)
రెండు వాయువుల వ్యాపన రేట్లు వరుసగా 1,2 లు అని, వాటి బాష్ప సాంద్రతలు VD1, VD2 లు అని అనుకుంటే
అపుడు, \(\frac{r_1}{r_2}\) = \(\sqrt{\frac{\mathrm{VD}_2}{\mathrm{VD}_1}}\) …… (2)
రెండు వాయువుల వ్యాపన రేట్లు వరుసగా r1, r2 లు అని, వాటి అణు భారాలు M1, M2 లు అని అనుకుంటే అపుడు,
\(\frac{r_1}{r_2}\) = \(\sqrt{\frac{\mathrm{M}_2}{\mathrm{M}_1}}\) …. (3)
(1), (2), (3) ల నుండి
\(\frac{r_1}{r_2}\) = \(\sqrt{\frac{d_2}{d_1}}\) = \(\sqrt{\frac{\mathrm{VD}_2}{\mathrm{VD}_1}}\) = \(\sqrt{\frac{\mathrm{M}_2}{\mathrm{M}_1}}\)
ప్రశ్న 50.
డాల్టన్ పాక్షిక పీడనాల నియమాన్ని తెలిపి, వివరించండి.
జవాబు:
డాల్టన్ పాక్షిక పీడనాల నియమం : స్థిర ఉష్ణోగ్రత వద్ద రసాయనికంగా చర్య జరపని వాయు మిశ్రమం కలుగ చేసే మొత్తం పీడనం అందులోని ఘటక వాయువుల పాక్షిక పీడనాల మొత్తానికి సమానం.
ఒక పాత్రలో మూడు వాయువుల మిశ్రమాన్ని తీసుకోండి. ఈ మిశ్రమంలో అనుఘటక వాయువుల పాక్షిక పీడనాలు వరుసగా P1, P2 మరియు P3 అయితే,
వాయు మిశ్రమం మొత్తం పీడనం p = p1 + p2 + p3
వాయువుల మోల్ల సంఖ్యలు n1, n2, n3
అయితే మోల్ భాగాలు x1 = \(\frac{n_1}{n_1+n_2+n_3}\) ; x2 = \(\frac{n_2}{n_1+n_2+n_3}\) ; x3 = \(\frac{n_3}{n_1+n_2+n_3}\)
మొత్తం పీడనం P అయితే
పాక్షిక పీడనం p1 = x1· P
రెండవ వాయువు పాక్షిక పీడనం p2 = x2 . P
మూడవ వాయువు పాక్షిక పీడనం p3 = x3 . P

ప్రశ్న 51.
చలద్వాయు సమీకరణం నుండి
(a) బాయిల్ నియమం
(b) ఛార్లెస్ నియమం రాబట్టండి.
జవాబు:
(a) బాయిల్ నియమం : అణుచలన సిద్ధాంతంలోని అంశాల ప్రకారం, వాయు అణువుల సగటు గతిజ శక్తి దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.
అంటే KE ∝ T
కాని KE = \(\frac{1}{2} \mathrm{mn} \mathrm{u}_{\mathrm{rms}}^2\)
∴ \(\frac{1}{2} \mathrm{mnu}_{\mathrm{rms}}^2\) ∝ T
\(\frac{1}{2} \mathrm{mnu}_{\mathrm{rms}}^2\) = KT ….. (1)
చలద్వాయు సమీకరణం ప్రకారం
PV = \(\frac{1}{3} \mathrm{mnu}^2{ }_{\mathrm{rms}}\) లేక PV = \(\frac{2}{3} \cdot \frac{1}{2} \mathrm{mnu}_{\mathrm{rms}}^2\)
(2) వ సమీకరణంలో (1) ని ప్రతిక్షేపిస్తే
PV = \(\frac{2}{3}\) . KT
లేక V = \(\frac{2 \mathrm{KT}}{3 \mathrm{P}}\)
“T” ను స్థిరం చేస్తే అప్పుడు
V = స్థిరరాశి × \(\frac{1}{\mathrm{P}}\)
లేక V ∝ \(\frac{1}{\mathrm{P}}\) (T స్థిరం)
స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశి గల వాయు ఘనపరిమాణం దాని పీడనానికి విలోమానుపాతంలో ఉంటుంది.
ఇదే బాయిల్ నియమం.
(b) ఛార్లెస్ నియమం : అణుచలన సిద్ధాంతంలోని అంశాల ప్రకారం వాయు అణువుల సగటు శక్తి దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.

‘P’ ను స్థిరం చేస్తే అప్పుడు V = స్థిరం × Tలేక V ∝ T (P స్థిరం)
స్థిర పీడనం వద్ద నియమిత ద్రవ్యరాశి గల వాయువు ఘనపరిమాణం దాని పరమ ఉష్ణోగ్రతకు అనులోమాను- పాతంలో ఉంటుంది. ఇదే చార్లెస్ నియమం.
ప్రశ్న 52.
చలద్వాయు సమీకరణం నుండి (a) గ్రాహం నియమం (b) డాల్టన్ నియమం రాబట్టండి.
జవాబు:
V ఘనపరిమాణం గల ఒక పాత్రలో ఒక వాయువు ఒక్కొక్క అణువు భారం m1. వాయువులోని n1 అణువులు rms వేగం u1rms కలిగి ఉందనుకొందాం. ఆ వాయువు పీడనం p1 అనుకొంటే చలద్వాయు సమీకరణం ప్రకారం
P1 V = \(\frac{1}{3}\) m1n1 \(\mathrm{u}_{1 \mathrm{rms}}^2\)
లేదా p1 = \(\frac{1}{3} \frac{\mathrm{m}_1 \mathrm{n}_1 \mathrm{u}_{1 \mathrm{rms}}^2}{\mathrm{~V}}\)
పాత్రలోని వాయువును తొలగించి రెండో వాయువును తీసుకొంటే ఆ వాయువు ఘనపరిమాణం V, పీడనం p2, ఒక్కో అణువు భారం m2, అణువుల సంఖ్య n2 అయితే

రెండు వాయువులను అదే పాత్రలో తీసుకొంటే వాయు మిశ్రమం కలిగించే పీడనాన్ని pమొత్తం అనుకొంటే

గ్రాహం నియమం : ఒక వాయువుకు చల ద్వాయు సమీకరణం ప్రకారం p. V. = \(\frac{1}{3} \mathrm{mn} \mathrm{u}_{\mathrm{rms}}^2\)
mn = వాయువు ద్రవ్యరాశి, వాయువులో అవొగాడ్రో సంఖ్య అణువులు ఉంటే mn = M (మోలార్ ద్రవ్యరాశి)

కాబట్టి వాయువు వ్యాపనం రేటు దాని సాంద్రత వర్గమూలానికి విలోమానుపాతంలో ఉంటుంది. ఇదే గ్రాహం నియమం.
ప్రశ్న 53.
వాయు అణువుల గతిజశక్తికి సమీకరణాన్ని ఉత్పాదించండి.
జవాబు:
చలద్వాయు సమీకరణం ప్రకారం
P. V. = \(\frac{1}{3} \mathrm{mn} \mathrm{u}_{\mathrm{rms}}^2\)
n = N అయితే mn = M మోలార్ ద్రవ్యరాశి
p. V = \(\frac{1}{3} \mathrm{Mu}_{\mathrm{rms}}^2\) = \(\frac{2}{3}\left(\frac{1}{2} \mathrm{Mu}_{\mathrm{rms}}^2\right)\)
= \(\frac{2}{3} \mathrm{E}_{\mathrm{k}}\)….. (1)
Ek ఒక మోల్ వాయువు గతిజశక్తి ఒక మోల్ వాయువుకు p. V = RT …. (2)
పై సమీకరణాల ప్రకారం
\(\frac{2}{3}\)Ek = RT లేదా Ek = \(\frac{3}{2}\)RT
‘n’ మోల్ల వాయువుకు గతిజశక్తి Ek = \(\frac{3}{2}\)nRT
కాబట్టి నిర్దిష్ఠ ఉష్ణోగ్రత వద్ద ఒక మోల్ ఏ వాయువైనా ఒకే గతిజశక్తి కలిగి ఉంటుంది. ఒక వాయు అణువు గతిజశక్తి.
\(\frac{E_k}{N}\) = \(\frac{3}{2}\left(\frac{\mathrm{R}}{\mathrm{N}}\right) \mathrm{T}\) = \(\frac{3}{2} \mathrm{kT}\)
k ను బోల్ట్స్మన్ స్థిరాంకం అంటారు.
k = \(\frac{\mathrm{R}}{\mathrm{N}}\)
ఒక అణువు వాయువు యొక్క స్థిరాంకం బోల్ట్స్మన్ స్థిరాంకం
k = 1.38 × 10-16 erg K-1 molecule-1 = 1.38 × 10-23 JK-1 molecule-1
ప్రశ్న 54.
వాయు అణువుల
(a) rms వేగం
(b) సగటు వేగం
(c) గరిష్ఠ సంభావ్యత వేగాలను నిర్వచించి, వాటి మధ్యగల సంబంధాన్ని తెలపండి.
జవాబు:
a) rms వేగం : వాయువులోని అణువులు వేగాలు వర్గాల సగటు యొక్క వర్గ మూలాన్ని (root mean square velocity) RMS వేగం అంటారు.

b) సగటు వేగం : ఒక వాయువులో N అణువులు ఉండి, అణువుల వేగాలు u1, u2….. un గా ఉంటే వాయు అణువుల సగటు వేగం

c) గరిష్ఠ సంభావ్యతా వేగం : వాయువులో గరిష్ఠ సంఖ్య అణువులకుండే వేగాన్ని గరిష్ఠ సంభావ్యతా వేగం అంటారు.
ump = \(\sqrt{\frac{2 \mathrm{RT}}{\mathrm{M}}}\)
అణువేగాల నిష్పత్తి : వాయువులోని మూడు రకాల అణువేగాల నిష్పత్తి

సగటు వేగం = 0.9213 × urms
గరిష్ఠ సంభావ్యతా వేగం = 0.8166 × urms
ప్రశ్న 55.
వాండర్ వాల్స్ స్థిరాంకాల భౌతిక ప్రాధాన్యతను వివరించండి.
జవాబు:
(p + \(\frac{\mathrm{an}^2}{\mathrm{v}^2}\))(v – nb) = nRT ఈ సమీకరణాన్ని వాండర్ వాల్స్ సమీకరణం అంటారు. n మోల్ల సంఖ్య a, b లు వాండర్ వాల్ స్థిరాంకాలు. ‘a’ విలువలు వాయువు స్వభావం మీద ఆధారపడి ఉంటాయి. ‘a’ విలువ వాయు అణువుల మధ్య ఉండే అంతర అణు ఆకర్షణ బలాల పరిమాణాన్ని తెలుపుతుంది. దీని విలువ వాయు పీడనం, ఉష్ణోగ్రతలపై ఆధారపడి ఉండదు.
‘b’ అనునది వాయు అణువులు తమంతట తాము ఆక్రమించే ఘనపరిమాణానికి కొలత. అధిక పీడనాల వద్ద వాయు ఘనపరిమాణం స్వల్పం. వాయు అణువులు తమంతట తాము ఆక్రమించే ఘనపరిమాణాన్ని నిర్లక్ష్యం చేయడానికి వీలులేదు. b ని వర్జిత ఘనపరిమాణం అంటారు.
ప్రశ్న 56.
ద్రవాల తలతన్యత అంటే ఏమిటి ? ద్రవాల తలతన్యతపై ఉష్ణోగ్రత ప్రభావాన్ని వివరించండి.
జవాబు:
ద్రవాలలో ఉండే అంతర అణు ఆకర్షణ బలాలే స్నిగ్ధతకు కారణం. ఇది ద్రవాల అభిలాక్షణిక ధర్మం.

ద్రవం లోపల ఒక అణువును తీసుకుంటే దానిపై పనిచేసే అంతర అణు బలాలు అన్ని దిశలలో ఉండటం వల్ల దానిపై పనిచేసే నికరబలం ఏమీ ఉండదు. ఇది ద్రవంలోపల ఉన్న అన్ని అణువులకు వర్తిస్తుంది. అదే ద్రవ ఉపరితలంపై ఉన్న అణువును పరిశీలిస్తే దానిపై అంతర అణు బలాలు కేవలం లోపలివైపుకే పని చేస్తాయి. దీనివల్ల అణువు ద్రవంలోపలికి లాగబడుతుంది. అందువల్ల ద్రవం ఉపరితల వైశాల్యం సాధ్యమైనంతగా తగ్గడానికి ప్రయత్నిస్తుంది. దీనివల్ల ద్రవ ఉపరితలం మీద గల అణువులు అంతర అణుబలాల ద్వారా క్రింది వైపుకు లాగబడతాయి. ద్రవం లోపలి అణువుల కంటె ఎక్కువ శక్తితో ఉంటాయి. అందువల్ల ద్రవ ఉపరితలం తక్కువ సంఖ్యలో అణువులను కలిగి ఉండటానికి ప్రయత్నిస్తుంది. అందువల్ల ద్రవ ఉపరితలం కుచించుకు పోయినట్లుగా ప్రవర్తిస్తుంది. ద్రవాల ఈ ధర్మాన్నే (లేక) ప్రవృత్తినే తలతన్యత అంటారు.
ద్రవ ఉపరితలం అణువుపైన, లోపలి భాగం అణువుపైన పనిచేసే బలాలు.
ఉదా : 1) తలతన్యత కారణంగా ద్రవ బిందువులు గోళాకారంగా ఉంటాయి.
2) సందిగ్ధ ఉష్ణోగ్రత వద్ద ద్రవాల తలతన్యత సున్న.
3) తలతన్యత కారణంగానే కేశనాళికలోని ద్రవాలు పైకి ప్రసరిస్తాయి.
ద్రవ ఉపరితల వైశాల్యాన్ని ఒక యూనిట్ పెంచడానికి అవసరమయ్యే శక్తిని ఉపరితలశక్తి అంటారు. దీని ప్రమాణాలు Jm-2. ద్రవ ఉపరితలంపై గీసిన రేఖకు లంబ దిశలో ఏకాంత పొడవుపై పనిచేసే బలాన్ని తలతన్యత అంటారు. తలతన్యత ప్రమాణాలు Kgs-2 SI ప్రమాణాల్లో N m-1
ఉష్ణోగ్రత పెరుగుదలతో పాటు ద్రవాల తలతన్యత తగ్గుతుంది. దీనికి కారణం ఉష్ణోగ్రత పెంచితే అణువుల శక్తి పెరిగి, అణువుల మధ్య ఆకర్షణా బలాలు తగ్గడమే.
ప్రశ్న 57.
ద్రవాల బాష్ప పీడనం అంటే ఏమిటి ? ద్రవాల బాష్ప పీడనం, వాటి బాష్పీభవన ఉష్ణోగ్రతల మధ్య సంబంధాన్ని తెలపండి.
జవాబు:
ద్రవ ఉపరితలంపై దాని బాష్పం కలగజేసే పీడనాన్ని ద్రవ బాష్పపీడనం అంటారు. ఏ ఉష్ణోగ్రత వద్ద ద్రవం బాష్పపీడనం బాహ్యపీడనానికి సమానమవుతుందో ఆ ఉష్ణోగ్రతను ఆ పీడనం వద్ద ద్రవం బాష్పీభవన ఉష్ణోగ్రత అంటారు. ద్రవం యొక్క బాష్పీకరణం ఉష్ణోగ్రత మీద ఆధారపడి ఉంటుంది. కనుక ద్రవం బాష్పపీడనాన్ని తెలిపేటప్పుడు ఉష్ణోగ్రతను తప్పకుండా పేర్కొనాలి.
ప్రశ్న 58.
స్నిగ్ధత, స్నిగ్ధతా గుణకాలను నిర్వచించండి. ద్రవాల స్నిగ్ధత ఉష్ణోగ్రతతో ఏవిధంగా మారుతుంది ?
జవాబు:
ఒక ద్రవం ప్రవహిస్తున్నపుడు ద్రవపు పొరలు ఒక దాని నుంచి ఇంకొకటి ముందుకు కదలడానికి ప్రయత్నిస్తాయి. ద్రవప్రవాహంలో పొరల మధ్య రాపిడి లేదా ఘర్షణ వల్ల ద్రవ ప్రవాహాన్ని నిరోధించే కొలతని స్నిగ్ధత అంటారు. ద్రవ అణువుల మధ్య ఉండే బలమైన అంతర అణుబలాలు ద్రవపు పొరలను కలిపి ఉంచి ఆ పొరలు ఒకదాని నుంచి ఇంకొకటి ముందుకు జారిపోకుండా అడ్డుపడతాయి. dz దూరంలో ఉన్న పొర వేగంలో మార్పు du అనుకొంటే ఆ పొర వేగ ప్రవీణత \(\frac{\mathrm{du}}{\mathrm{d} z}\) అవుతుంది. ద్రవపు పొరల ప్రవాహాన్ని నడపడానికి బలం కావాలి. ఈ బలం పొరల స్పర్శా వైశాల్యానికి, పొరవేగ ప్రవీణతకు అనులోమానుపాతంలో ఉంటుంది.
F ∝ A. \(\frac{d u}{d z}\)
F = ηA \(\frac{d u}{d z}\)
η అనుపాత స్థిరాంకం. దీనిని స్నిగ్ధతా గుణకం అంటారు. ఏకాంక స్పర్శా వైశాల్యం, ఏకాంక వేగ ప్రవీణత గల ద్రవ ప్రవాహపు పొరపై పనిచేసే బలాన్ని స్నిగ్ధతా గుణకం అంటారు. స్నిగ్ధతా గుణకానికి CGS ప్రమాణాలు పాయిస్.
ఉష్ణోగ్రతా ప్రభావం : ద్రవాల స్నిగ్ధత ఉష్ణోగ్రతలో పెరుగుదలతో పాటు తగ్గుతుంది. దీనికి కారణం అధిక ఉష్ణోగ్రతల వద్ద ద్రవ అణువుల గతిజ శక్తి పెరిగి, అంతర అణు బలాలను అధిగమించి అణువులు ఒక పొర నుండి మరొక పొరలోకి తేలికగా జారిపోతుంటాయి.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 59.
అంతర అణుబలాలను వివరించండి.
జవాబు:
ఒక పదార్థంలోని కణాలైన పరమాణువులు లేదా అణువుల మధ్య ఉండే ఆకర్షణ, వికర్షణ బలాలను అంతర
అణుబలాలు అంటారు.
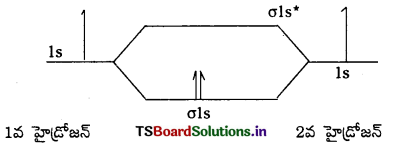
1. విక్షేపణ బలాలు లేక లండన్ బలాలు : పరమాణువులు, అధృవ అణువులు విద్యుదావేశ రహితాలు. అంతేకాక ఎలక్ట్రాన్ ఆవేశ మేఘం సౌష్టవంగా ఉండి అణువులకు ద్విధ్రువ భ్రామకం ఉండదు. అటువంటి అణువులు లేదా పరమాణువులలో కూడా తాత్కాలిక ద్విధ్రువం ఏర్పడవచ్చు. ఈ తాత్కాలిక ద్విధ్రువాల మధ్య ఆకర్షణ ఏర్పడుతుంది. ఈ విధమైన ఆకర్షణ బలాలను లండన్ బలాలు అంటారు. రెండు తాత్కాలిక ద్విధ్రువాల మధ్య ఉండే ఆకర్షణా బలాలను లండన్ బలాలు అంటారు. ఈ ఆకర్షణ బలాల అంతర చర్య శక్తి, అంతర చర్య జరిపే కణాల మధ్య దూరం యొక్క ఆరవ ఘాతాంకానికి విలోమానుపాతంలో ఉంటుంది. అంతర చర్య శక్తి ∝ \(\frac{1}{r^6}\)
2. ద్విధ్రువ-ద్విధ్రువ ఆకర్షణ బలాలు : శాశ్వత ద్విధ్రువాల మధ్య ఉండే బలాలను ద్విధ్రువ-ద్విధ్రువబలాలు అంటారు. ద్విధ్రువాల చివరలు పాక్షిక ఆవేశాలను కలిగి ఉంటాయి. ఈ ఆవేశాలను గ్రీకు అక్షరం (8) (డెల్టా)తో సూచిస్తారు. ఈ పాక్షిక ఆవేశాలు ఎలక్ట్రాన్ ఆవేశం (1.6× 10-19 కులూంబులు) కంటే తక్కువగా ఉంటాయి. ధ్రువాణువుల సమీప అణువులతో అంతర చర్యలు జరుపుతాయి. ఈ ద్విధ్రువాల అంతర ఆకర్షణా బలాలు లండన్ విక్షేపణ బలాలకన్నా బలమైనవి. కాని అయాన్-అయాన్ అంతర ఆకర్షణల కంటే బలహీనమైనవి. ద్విధ్రువ-ద్విధ్రువ ఆకర్షణ బలాల శక్తి ధ్రువాణువుల మధ్య దూరానికి విలోమానుపాతంలో ఉంటుంది.

ధ్రువాణువుల మధ్య అంతర ఆకర్షణ బలాలు ∝ \(\frac{1}{r^3}\)
భ్రమణం చెందే ధృవాణువుల అంతర ఆకర్షణ బలాలు ∝ \(\frac{1}{r^6}\)
3. ద్విధ్రువ – ప్రేరిత ద్విధ్రువ బలాలు : ఈ బలాలు శాశ్వత ద్విధ్రువ భ్రామకం ఉన్న అణువుకు శాశ్వత ద్విధ్రువ భ్రామకం లేని అణువులకు మధ్య ఉత్పన్నమవుతాయి. శాశ్వత ద్విధ్రువ భ్రామకం గల ధ్రువాణువుల తటస్థ అణువుల ఎలక్ట్రాన్ మేఘాలను రూప భ్రంశం చెందిస్తాయి. ఆ తటస్థ అణువుల్లో ద్విధ్రువ లక్షణాన్ని ప్రేరేపిస్తాయి.
ఈ విధంగా ఏర్పడిన ద్విధ్రువ – ప్రేరిత ద్విధ్రువ బలాల అంతర చర్యశక్తి \(\frac{1}{r^6}\) కు అనులోమానుపాతంలో ఉంటుంది. ఇక్కడ r అనేది రెండు అణువుల మధ్య దూరం. ఈ ప్రేరిత ద్విధ్రువం, ద్విధ్రువ భ్రామకం విలువ, శాశ్వత ద్విధ్రువ అణువు ద్విధ్రువ భ్రామకం విలువ మీద, తటస్థ అణువు ధ్రువణ శీలత మీద ఆధారపడి ఉంటుంది.


ప్రశ్న 60.
బాయిల్, ఛార్లెస్, అవొగాడ్రో నియమాలను తెలిపి, ఆదర్శ వాయు సమీకరణాన్ని ఉత్పాదించండి.
జవాబు:
బాయిల్ నియమం : స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశి గల వాయు ఘనపరిమాణం పీడనానికి విలోమాను- పాతంలో ఉంటుంది.
V ∝ (n, Tలు స్థిరం)
ఛార్లెస్ నియమం : స్థిర పీడనం వద్ద నియమిత ద్రవ్యరాశిగల వాయు ఘనపరిమాణం పరమ ఉష్ణోగ్రతకు అనులోమాను- పాతంలో ఉంటుంది. V ∝ T (n, P లు స్థిరం)
అవొగాడ్రో నియమం : స్థిర ఉష్ణోగ్రత, పీడనాల వద్ద సమాన ఘనపరిమాణం గల వాయువులలో మోల్ల సంఖ్య సమానం. V ∝ (p, T లు స్థిరం)
పై మూడు నియమాలను కలిపి వ్రాస్తే ఘనపరిమాణం, పీడనం, పరమ ఉష్ణోగ్రత మరియు మోల్ల సంఖ్యకు మధ్యగల సంబంధాన్ని తెలియచేసే సమీకరణం వస్తుంది. దీనినే ఆదర్శవాయు సమీకరణం అంటారు.
V ∝ \(\frac{1}{P}\)(n, T లు స్థిరం) బాయిల్ నియమం
V ∝ T (p, n లు స్థిరం) ఛార్లెస్ నియమం
V ∝ n (p, Tలు స్థిరం) అవొగాడ్రో నియమం
పై మూడు సూత్రాలను కలిపి వ్రాస్తే
V ∝ \(\frac{1}{p}\). T. n లేక V = R. \(\frac{1}{p}\) . T . n
లేక pV = nRT ఇదే ఆదర్శవాయు సమీకరణం
p = పీడనం,
V = ఘనపరిమాణం,
T = పరమ ఉష్ణోగ్రత,
n = మోల్ల సంఖ్య,
R = వాయు స్థిరాంకం.
ప్రశ్న 61.
వాయువుల వ్యాపనంపై వ్యాసం రాయండి.
జవాబు:
స్థిర ఉష్ణోగ్రత, పీడనాల వద్ద వాయు వ్యాపన రేటు దాని సాంద్రత వర్గమూలానికి, లేదా బాష్పసాంద్రత వర్గ మూలానికి, లేదా అణుభారానికి విలోమానుపాతంలో ఉంటుంది. తేలికైన వాయువులు తొందరగా వ్యాపనం చెందుతాయి.

రెండు వాయువుల వ్యాపనరేట్లు r1, r2 మరియు సాంద్రతలు d1, d2 అయితే

Case 1 : వాయు వ్యాపన కాలాలు సమానమైతే

Case 2 : వాయువుల ఘనపరిమాణాలు సమానమైతే

వ్యాపనం అనువర్తనాలు :
- వాయువుల వ్యాపన రేట్లు పోల్చి, ఒక వాయువు అణుభారం తెలిస్తే, రెండో వాయువు అణు భారాన్ని కనుక్కోవచ్చు.
- U235, U238 ఐసోటోపులను, తేలికగా బాష్పంగా మారే U235F6, U238F6 గా మార్చి వ్యాపనం రేట్లలో తేడా వల్ల రెండు ఐసోటోపులను వేరు చేస్తారు.
- బొగ్గు గనులలో వెలువడే ప్రమాదకరమైన మార్ష్ వాయువును గుర్తించే అన్సిల్ అలారం వాయువుల వ్యాపన ధర్మంపై ఆధారపడి పనిచేస్తుంది.
ప్రశ్న 62.
డాల్టన్ పాక్షిక పీడనాల సిద్ధాంతాన్ని వివరించండి.
జవాబు:
డాల్టన్ పాక్షిక పీడనాల నియమం : స్థిర ఉష్ణోగ్రత వద్ద రసాయనికంగా చర్య జరపని వాయు మిశ్రమం కలుగజేసే మొత్తం పీడనం అందులోని అనుఘటక వాయువుల పాక్షిక పీడనాల మొత్తానికి సమానం.
ఒక పాత్రలో మూడు వాయువుల మిశ్రమాన్ని తీసుకోండి. ఈ మిశ్రమంలో అనుఘటక వాయువుల పాక్షిక పీడనాలు వరుసగా p1 p2 మరియు p3 అనుకొనుము. అపుడు డాల్టన్ పాక్షిక పీడనాల నియమం ప్రకారం P = p1 + p2 + p3· ఇచ్చట P = వాయు మిశ్రమం మొత్తం పీడనం.
వాయువులను సాధారణంగా నీటిపైన సంగ్రహిస్తాం. ఆ సమయంలో వాయువుతో పాటు కొంచెం తేమ కూడా కలిసి ఉంటుంది. పొడి వాయువు పీడనాన్ని తెలుసుకోవడానికి, తడి వాయువు మొత్తం పీడనం నుండి నీటి బాష్పపీడనాన్ని తీసి వేయాలి. Pపొడి వాయువు మొత్తం = Pమొత్తం – నీటి ఆవిరి సంతృప్త బాష్పపీడనం.
V ఘనపరిమాణంగల పాత్రలో ఈ ఉష్ణోగ్రత వద్ద వాయువుల పాక్షిక పీడనాలు వరుసగా p1, p2, p3 అయితే

n = మొత్తం మోత్ల సంఖ్య
∴ మొదటి వాయువు పాక్షిక పీడనం
p1 = Pమొత్తం . x1
p2 = Pమొత్తం . x2
p3 = Pమొత్తం . x3
x1, x2, x3 లు వాయువుల మోల్ భాగాలు.
∴ పాక్షిక పీడనం = మొత్తం పీడనం × మోల్ భాగం
ఈ విధంగా మొత్తం పీడనం తెలిస్తే వ్యక్తిగత వాయువుల పాక్షిక పీడనాలను లెక్కకట్టవచ్చు.
ప్రశ్న 63.
వాయువుల అణుచలన సిద్ధాంతంలోని అంశాలను రాయండి. (March 2013)
జవాబు:
అణుచలన సిద్ధాంతంలోని ముఖ్యాంశాలు :
- ప్రతి వాయువులోను అసంఖ్యాకమైన చిన్న చిన్న కణాలు ఉంటాయి. వీటిని అణువులు అంటారు.
- వాయు అణువులు గట్టిగా, గోళాకారంగా ఉండి స్థితిస్థాపక ధర్మాన్ని కలిగి ఉంటాయి.
- వాయు అణువులు అన్ని దిశలలో అధిక వేగాలతో ఋజు మార్గాలలో ప్రయాణిస్తూ ఉంటాయి. తత్ఫలితంగా అవి ఒక దానితో ఒకటి ఢీకొనడమే కాకుండా పాత్ర యొక్క గోడలతో కూడా ఢీ కొంటాయి. అందువలన అణువుల వేగాలు మరియు దిశా మార్గాలు నిరంతరం మారుతూ ఉంటాయి.
- వాయు ఘనపరిమాణంతో పోలిస్తే వాయు అణువులు ఆక్రమించే ఘనపరిమాణం చాలా స్వల్పంగా ఉంటుంది.
- వాయు అణువుల మధ్య ఆకర్షణ బలాలు గాని, వికర్షణ బలాలు గాని ఉండవు.
- వాయు అణువులు ఒక దానితో ఒకటి ఢీ కొన్నప్పుడు గాని లేదా పాత్ర యొక్క గోడలతో ఢీకొన్నప్పుడు గాని గతిశక్తిలో మార్పు ఏమీ ఉండదు.
- వాయు అణువులు పాత్ర గోడలతో ఢీ కొనడం వలన వాయువులకు పీడనం ఏర్పడుతుంది.
- వాయు అణువు సగటు గతిశక్తి దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది. i.e. గతిశక్తి ∝ T.
- వాయు అణువుల కదలికపై భూమ్యాకర్షణ బలాలు ఏవీ ఉండవు.
అణుచలన సిద్ధాంతం ఆధారంగా బాయిల్ సూత్రాన్ని వివరించుట : అణుచలన సిద్ధాంతం ప్రకారం, వాయు అణువులు పాత్ర గోడలతో ఢీ కొనడం వలన వాయువులకు పీడనం ఏర్పడుతుంది. స్థిర ఉష్ణోగ్రత వద్ద వాయు అణువులు పాత్ర యొక్క గోడలతో స్థిర సంఖ్యలో తాడనాలు చేస్తాయి. వాయు ఘనపరిమాణంను తగ్గిస్తే వాయు అణువులు ప్రయాణించవలసిన దూరం తగ్గిపోతుంది. తత్ఫలితంగా ప్రమాణ ఘనపరిమాణంపై వాయు అణువుల తాడనాలు పెరుగుతాయి. కాబట్టి వాయు పీడనం పెరుగుతుంది. అంటే స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశి గల వాయు ఘనపరిమాణం దాని పీడనానికి విలోమానుపాతంలో ఉంటుంది. ie V ∝ \(\frac{1}{p}\) (Tస్థిరం). ఇదే బాయిల్ నియమం. అణుచలన సిద్ధాంతం ఆధారంగా ఛార్లెస్ సూత్రాన్ని వివరించుట : అణుచలన సిద్ధాంతం ప్రకారం వాయు అణువుల సగటు గతిశక్తి దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది. i.e. KE ∝ T కాని KE = \(\frac{1}{2}\) mV2.
∴ \(\frac{1}{2}\) mV2 ∝ T లేక V2 ∝ T లేక V ∝ T. దీనినిబట్టి ఉష్ణోగ్రత పెరిగితే వాయు అణువుల వేగం పెరుగుతుంది. తత్ఫలితంగా పాత్ర యొక్క గోడలపై వాయు అణువుల తాడనాలు పెరుగుతాయి. అప్పుడు వాయు పీడనం పెరుగుతుంది. కాని ఛార్లెస్ నియమానికి పీడనం స్థిరంగా ఉండాలి. ఉష్ణోగ్రత పెంచినా పీడనం స్థిరంగా ఉండాలంటే ఘనపరిమాణం పెరగాలి. మరొక విధంగా చెప్పాలంటే స్థిర పీడనం వద్ద నియమిత ద్రవ్యరాశి గల వాయు ఘనపరిమాణము దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది. i.e., V ∝ T (p స్థిరం). ఇదే ఛార్లెస్ నియమం.
ప్రశ్న 64.
చలద్వాయు సమీకరణం నుంచి వాయు నియమాలను రాబట్టండి.
జవాబు:
(a) బాయిల్ నియమం : అణుచలన సిద్ధాంతంలోని అంశాల ప్రకారం, వాయు అణువుల సగటు గతిజ శక్తి దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.

“T” ను స్థిరం చేస్తే అప్పుడు
V = స్థిరరాశి × \(\frac{1}{P}\)
లేక V ∝ \(\frac{1}{P}\) (T స్థిరం)
స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశి గల వాయు ఘనపరిమాణం దాని పీడనానికి విలోమానుపాతంలో ఉంటుంది. ఇదే బాయిల్ నియమం.
(b) ఛార్లెస్ నియమం : అణుచలన సిద్ధాంతంలోని అంశాల ప్రకారం వాయు అణువుల సగటు శక్తి దాని పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.

‘P’ ను స్థిరం చేస్తే అప్పుడు V = స్థిరం × Tలేక V ∝ T (P స్థిరం)
స్థిర పీడనం వద్ద నియమిత ద్రవ్యరాశి గల వాయువు ఘనపరిమాణం దాని పరమ ఉష్ణోగ్రతకు అనులోమాను – పాతంలో ఉంటుంది. ఇదే ఛార్లెస్ నియమం.
c) డాల్టన్ పాక్షిక పీడనాల నియమం : V ఘనపరిమాణం గల ఒక పాత్రలో ఒక వాయువు ఒక్కొక్క అణువు భారం m1. వాయువులోని n1 అణువులు rms వేగం \(\mathrm{u}_{\mathrm{l}_{\mathrm{rms}}}\) కలిగి ఉందనుకొందాం. ఆ వాయువు పీడనం p1 అనుకొంటే చలద్వాయు సమీకరణం ప్రకారం
P1 V = \(\frac{1}{3} \mathrm{~m}_1 \mathrm{n}_1 \mathrm{u}_{1 \mathrm{rms}}^2\)
లేదా p1 = \(\frac{1}{3} \frac{\mathrm{m}_1 \mathrm{n}_1 \mathrm{u}_{1 \mathrm{rms}}^2}{\mathrm{~V}}\)
పాత్రలోని వాయువును తొలగించి రెండో వాయువును తీసుకొంటే ఆ వాయువు ఘనపరిమాణం V, పీడనం p2, ఒక్కో అణువు భారం m2, అణువుల సంఖ్య n2 అయితే

రెండు వాయువులను అదే పాత్రలో తీసుకొంటే వాయు మిశ్రమం కలిగించే పీడనాన్ని pమొత్తం అనుకొంటే

pమొత్తం = p1 + p2
d) గ్రాహం నియమం : ఒక వాయువుకు చల ద్వాయు సమీకరణం ప్రకారం p. V. = \(\frac{1}{3} \mathrm{mnu}_{\mathrm{rms}}^2\)
mn = వాయువు ద్రవ్యరాశి, వాయువులో అవొగాడ్రో సంఖ్య అణువులు ఉంటే mn = M (మోలార్ ద్రవ్యరాశి)
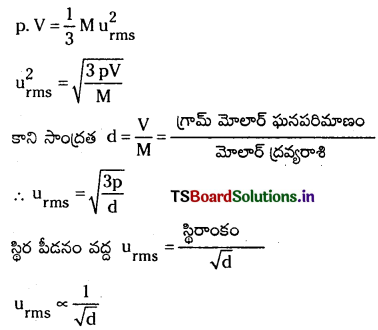
కాబట్టి వాయువు వ్యాపనం రేటు దాని సాంద్రత వర్గమూలానికి విలోమానుపాతంలో ఉంటుంది. ఇదే గ్రాహం నియమం.

ప్రశ్న 65.
మాక్స్వెల్ – బోల్డైమెన్ అణువేగాల పంపిణీ వక్రరేఖలను వివరించండి. ఈ రేఖల ఆధారంగా తెలిసిన అంశాలేమిటి? అణువేగాల పంపిణీపై ఉష్ణోగ్రత ప్రభావాన్ని చర్చించండి.
జవాబు:
అణుచలన సిద్ధాంతం ప్రకారం, వాయు అణువులు అన్ని దిశలలో క్రమ రాహిత్యంగా ప్రయాణిస్తూ ఉంటాయి. ఈ క్రమ రాహిత్య ప్రయాణ కాలంలో వాయు అణువులు ఒక దానితో ఒకటి ఢీకొనడమే కాకుండా పాత్ర యొక్క గోడలతో కూడా ఢీ కొంటాయి. తత్ఫలితంగా అణువులు వేగాలు నిరంతరం ఒక కనిష్ఠ విలువ నుండి (సున్నకు అతి దగ్గర విలువ) ఒక గరిష్ఠ విలువ వరకు మార్పు చెందుతూ ఉంటాయి. అసంఖ్యాక అణు తాడనాలతో సంబంధం లేకుండా ఒకానొక వేగ విలువ కలిగి ఉన్న అణువుల సంఖ్యకు మొత్తం అణువుల సంఖ్యకు గల నిష్పత్తి ఎల్లప్పుడూ స్థిరంగా ఉంటుంది. ఈ నిష్పత్తిని గణాంక పద్ధతుల ద్వారా నిర్ణయిస్తారు. మాక్స్వెల్ – బోల్టైమెన్ అణువేగాల పంపక రేఖలను క్రింది విధంగా సూచించినారు.

వక్రాల నుండి నిర్ణయాలు :
- అతిస్వల్ప సంఖ్యలో అణువులు అత్యల్ప లేక అతి గరిష్ఠ వేగాలను కలిగి ఉంటాయి.
- వక్రంలోని గరిష్ఠ బిందువు గరిష్ఠ సంభావ్యతా వేగాన్ని తెలియజేస్తుంది. గరిష్ఠ సంఖ్యలోని అణువులు కలిగి ఉండే వేగాన్ని గరిష్ఠ సంభావ్యతా వేగం అంటారు.
- వాయు అణువుల సరాసరి వేగం, వాటి గరిష్ఠ సంభావ్యతా వేగం కన్నా ఎక్కువగా ఉంటుంది.
- వాయు అణువుల RMS వేగం, వాటి గరిష్ఠ సంభావ్యతా వేగం మరియు సరాసరి వేగాల కన్నా ఎక్కువగా ఉంటుంది.
- వాయు అణువుల వేగాలు పెరిగే కొలది, ఒకానొక ప్రత్యేక విలువ కలిగి ఉన్న అణువుల భాగం కూడా క్రమంగా పెరిగి గరిష్ఠ విలువను చేరుకుని ఆ తరువాత క్రమంగా తగ్గుతుంది.
- ఉష్ణోగ్రత పెరిగే కొలది, వక్రం కుడివైపుకు జరగటమే కాకుండా వక్రం యొక్క ఎత్తు తగ్గి స్వల్పంగా సమతలంగా మారుతుంది. దీనినిబట్టి తెలిసేది ఏమనగా అధిక ఉష్ణోగ్రతల వద్ద అల్ప వేగాలు కలిగి ఉన్న అణువుల భాగం తగ్గి అధిక వేగాలు కలిగి ఉన్న అణువుల భాగం పెరుగుతుంది.
ప్రశ్న 66.
నిజ వాయువుల ప్రవర్తన, ఆదర్శ వాయు ప్రవర్తన నుంచి విచలనాన్ని వివరించండి.
జవాబు:
నిజవాయువుల ధర్మాలను తెలుసుకోవడానికి సంపీడన గుణకం చాలా అవసరం. దీనిని ‘Z’ తో సూచిస్తారు. దీని విలువను pV, nRT ల లబ్ధాల నిష్పత్తిగా సూచిస్తారు.
Z = \(\frac{\mathrm{pV}}{\mathrm{nRT}}\)
ఆదర్శ వాయువులకు pV = nRT కాబట్టి అన్ని ఉష్ణోగ్రత పీడనాలవద్ద ఆదర్శ వాయువులకు Z = 1 అవుతుంది. ఆదర్శ వాయువుల సంపీడన గుణకం Z, పీడనం p మధ్య గ్రాఫ్ పీడన అక్షానికి సమాంతరంగా సరళరేఖగా ఉంటుంది. అత్యల్ప పీడనాల వద్ద అన్ని వాయువులు 2 = 1 విలువ కలిగి ఉండి ఆదర్శ వాయువు వలె ప్రదర్శిస్తాయి.
అధిక పీడనాల వద్ద వాయువులు Z > 1 విలువను కలిగి ఉంటాయి. మధ్యస్థ పీడనాల వద్ద చాలా వాయువులు Z < 1 విలువను కలిగి ఉంటాయి.
కాబట్టి వాయువు ఆక్రమించే ఘనపరిమాణం ఎక్కువగా ఉండి, దానితో పోలిస్తే వాయు అణువులు ఆక్రమించే ఘ॥ప విస్మరించదగినదిగా ఉన్నపుడు వాయువులు ఆదర్శ ప్రవర్తనను కలిగి ఉంటాయి.

వాయువు ఆదర్శ వాయువు అయితే

ప్రశ్న 67.
వాండర్ వాల్స్ స్థితి సమీకరణాన్ని ఉత్పాదించండి. వాండర్ వాల్స్ సమీకరణం ప్రాముఖ్యతను వివరించండి.
జవాబు:
నిజవాయువులు అన్ని పరిస్థితులలోను బాయిల్ నియమం, ఛార్లెస్ నియమం, అవొగాడ్రో నియమాలను కచ్చితంగా పాటించవని ప్రయోగాల ద్వారా తెలిసింది.
దీనికి కారణం వాయువుల అణుచలన సిద్ధాంతంలోని రెండు లోప భూయిష్ఠమయిన ప్రతిపాదనలు.
a) వాయు అణువుల మధ్య ఎటువంటి ఆకర్షణ బలం ఉండదు.
b) వాయు అణువుల ఘనపరిమాణం, అవి ఆక్రమించే ఘనపరిమాణంతో పోలిస్తే విస్మరించదగినంత తక్కువగా ఉంటుంది.
ప్రతిపాదన (a) సరియైనదైతే, వాయువు ద్రవీకృతంకాదు. వాయువులను సంపీడ్యం చెందించి, చల్లబరిస్తే వాయువులు ద్రవీకరణం చెందుతాయి. అధిక పీడనాల వద్ద అణువులు చాలా దగ్గరగా వుండి అణువుల మధ్య అన్యోన్య చర్యలు మొదలవుతాయి. అందువల్ల వాయు అణువులు పాత్ర గోడలపై అనుకున్న దాని కంటే తక్కువ వేగంతో తాడనాలు కలుగచేస్తాయి. దీనికి కారణం వాయువులోని ఇతర అణువులు పాత్ర గోడలపై తాడనాలు చేసే అణువులను అంతర ఆకర్షణ బలాల వల్ల వెనక్కు లాగుతాయి. అందుచేత నిజవాయువులు కలుగచేసే పీడనం, ఆదర్శ వాయువులు కలుగచేసే పీడనం కంటే తక్కువగా ఉంటుంది.
p‘ఆదర్శ = pనిజ + \(\frac{\mathrm{an}^2}{\mathrm{~V}^2}\)
‘a’ వాండర్ వాల్ స్థిరాంకం.
ఘనపరిమాణానికి సవరణ : ప్రతిపాదన (b) సరియైనదైతే p – V గ్రాఫ్ నిజవాయువులకు ప్రయోగ పూర్వకంగా పొందినది, సిద్ధాంతపరంగా బాయిల్ నియమం ప్రకారం ఆదర్శవాయువుకు గణించినవి ఏకీభవించాలి. కాని అట్లా జరుగుట లేదు. వాయు అణువుల మధ్య ఉండే వికర్షణ బలాలు అణువులు సన్నిహితంగా ఉన్నపుడు ప్రాముఖ్యత కలిగి ఉంటాయి. అధిక పీడనాల వద్ద వాయు అణువుల మధ్య వికర్షణ బలాలను అల్ప వ్యాపక అంతర చర్య అంటారు. అది అణువులు చాలా దగ్గరగా ఉన్నపుడు మాత్రమే తగినంత ఉంటుంది. ఈ వికర్షణ బలాలు అణువులను చిన్న చిన్న చొచ్చుకుపోలేని గోళాలుగా ఉంచుతాయి. వాయు అణువులు ఆక్రమించే ఘనపరిమాణం కూడా ప్రాముఖ్యతను సంతరించుకుంటుంది. వాయు అణువులు V ఘనపరిమాణానికి బదులు (V – nb) అనే తక్కువ ఘనపరిమాణం గల ప్రదేశంలో చలించడానికి పరిమితమై ఉంటాయి. ఇక్కడ nb వాయు అణువుల మొత్తం ఘనపరిమాణాన్ని సూచిస్తుంది. ‘b’ స్థిరాంకం.
ఈ సవరణలతో ఆదర్శవాయు సమీకరణాన్ని కింది విధముగా వ్రాయవచ్చు.
(p + \(\frac{a n^2}{v^2}\))(V – nb) = nRT
ఈ సమీకరణాన్ని వాండర్ వాల్ సమీకరణం అంటారు. ‘n’ మోల్ల సంఖ్య. a, b లు వాండర్ వాల్ స్థిరాంకాలు. ‘a’ విలువ వాయు అణువుల మధ్య ఉండే అంతర అణు ఆకర్షణ బలాల పరిమాణాన్ని తెలుపుతుంది.
వాయు అణువుల మధ్య అంతర అణు ఆకర్షణ బలాలు దాదాపు శూన్యమయ్యే ఉష్ణోగ్రత పీడన పరిస్థితులలో నిజవాయువులు ఆదర్శ ప్రవర్తనను ప్రదర్శిస్తాయి.
వాండర్ వాల్ సమీకరణం ద్వారా నిజ వాయువుల ధన, ఋణ విచలనాలను వివరించవచ్చు.
ప్రశ్న 68.
వాయువుల ద్రవీకరణలో ఇమిడి ఉన్న సూత్రాన్ని వివరించండి.
జవాబు:
వాయువులను ద్రవీకరించాలంటే వాటి సందిగ్ధ ఉష్ణోగ్రత కంటే తక్కువ ఉష్ణోగ్రతకు చల్లబరచాలి. ఒక వాయువు ద్రవీకరణం చెందే గరిష్ఠ ఉష్ణోగ్రత దాని సందిగ్ధ ఉష్ణోగ్రత. శాశ్వత వాయువులను ద్రవీకరించాలంటే, వాటిని తగినంతగా సంపీడనం చెందించాలి. అంతేకాక చల్లబరచాలి. సంపీడనం చెందించినపుడు వాయు అణువులు సన్నిహితంగా వస్తాయి. చల్లబరిచినపుడు వాయు అణువుల కదలికలు తగ్గిపోయి అంతర అణు ఆకర్షణ బలాలు పెరిగి, అణువులు సన్నిహితంగా వచ్చి వాయువు ద్రవీకరించబడుతుంది.
30.98°C ఉష్ణోగ్రత వద్ద 73 అట్మా పీడనం వరకు CO2 వాయువుగానే ఉంటుంది. 73 అట్మా పీడనం వద్ద ద్రవ CO2 కనిపిస్తుంది. 30.98°C ఉష్ణోగ్రతను CO2 సందిగ్ధ ఉష్ణోగ్రత TC అంటారు.
ఏ ఉష్ణోగ్రత కన్నా అధిక ఉష్ణోగ్రత వద్ద అధిక పీడనాన్ని ఉపయోగించినప్పటికి వాయువును ద్రవీకరింప చేయలేమో ఆ ఉష్ణోగ్రతను సందిగ్ధ ఉష్ణోగ్రత అంటారు. (TC) సందిగ్ధ ఉష్ణోగ్రత గది ఉష్ణోగ్రత కన్నా ఎక్కుగా ఉన్న వాయువులను సులభంగా ద్రవీకరించవచ్చు.
ప్రశ్న 69.
ద్రవాల క్రింది ధర్మాలను వివరించండి.
a) బాష్ప పీడనం
b) తలతన్యత
c) స్నిగ్ధత
జవాబు:
a) బాష్ప పీడనం : ద్రవం ఉపరితలంపై దాని బాష్పం కలుగచేసే పీడనాన్ని బాష్పపీడనం అంటారు. ఈ బాష్పం కలుగ చేసే పీడనం పెరిగి కొంత సేపటికి ఇచ్చిన ఉష్ణోగ్రత వద్ద బాష్పపీడనం స్థిరవిలువకు చేరి ద్రవానికి, బాష్పానికి మధ్య సమతాస్థితి ఏర్పడుతుంది. ఈ స్థితిలో స్థిరంగా ఉన్న బాష్పపీడనాన్ని సమతా బాష్పపీడనం లేదా సంతృప్త బాష్పపీడనం అంటారు.
ఒక ప్రత్యేకమైన ఉష్ణోగ్రత వద్ద బాష్పపీడనం, బాహ్యపీడనానికి సమానమవుతుంది. ఈ ఉష్ణోగ్రత వద్ద బాష్పీకరణం కేవలం ద్రవం ఉపరితలం నుంచే కాక, ద్రవం అంతర్భాగం నుండి జరిగి, బాష్పం పరిసరాల్లోకి వ్యాకోచం చెందుతుంది. ఈ విధంగా ద్రవం అంతా బాష్పీకరణం చెందడాన్ని బాష్పీభవనం అంటారు. ఏ ఉష్ణోగ్రత వద్ద ద్రవం బాష్పపీడనం బాహ్యపీడనానికి సమానం అవుతుందో ఆ ఉష్ణోగ్రతను ఆ పీడనం వద్ద ద్రవం బాష్పీభవన ఉష్ణోగ్రత అంటారు. ద్రవాల బాష్పీభవన స్థానం బాహ్యపీడనంలో మార్పువల్ల మారుతుంది.
b) తలతన్యత : ద్రవంలోని అణువును ఒకదాన్ని తీసుకొంటే దానిపై అన్ని వైపుల నుండి సమానంగా అంతర అణుబాలాలు పనిచేస్తాయి. కాబట్టి ఆ అణువుపై పనిచేసే నికర బలం ఏమీ ఉండదు. కాని ద్రవ ఉపరితలంపై ఉన్న అణువుపై పనిచేసే నికర బలం ద్రవ అణువును లోపలి వైపుకు లాగుతుంది. ద్రవాలు సాధ్యమైనంత తక్కువ ఉపరితల వైశాల్యం కలిగి ఉండేటట్లు ప్రయత్నిస్తాయి. దీనివల్ల ఉపరితలం మీద అణువులు ఎక్కువ శక్తితో ఉంటాయి. ద్రవం లోపలి భాగం నుంచి ఒక అణువును ద్రవ ఉపరితలానికి తీసుకువచ్చి ఉపరితలాన్ని పెంచాలనుకుంటే, ఆకర్షణ బలాలను అధిగమించవలసి వస్తుంది. దీనికి శక్తి కావాలి.
ద్రవం ఉపరితల వైశాల్యాన్ని ఒక యూనిట్ పెంచడానికి అవసరమయ్యే శక్తిని ఉపరితల శక్తి అంటారు. దీని ప్రమాణాలు Jm-2. ద్రవం ఉపరితలంపై గీసిన రేఖకు లంబదిశలో ఏకాంక పొడవుపై పనిచేసే బలాన్ని తల- తన్యత అంటారు. తలతన్యత ప్రమాణాలు Kgs-2 లేదా SI ప్రమాణాల్లో Nm-1
ద్రవానికి ఉపరితల వైశాల్యం ఎంత తక్కువగా ఉంటే శక్తి అంత తక్కువగా ఉంటుంది. గోళాకార ఆకృతి ఈ ధర్మానికి అనుగుణంగా ఉంటుంది. అందువల్లే పాదరస బిందువులు గోళాకారంగా ఉంటాయి. అదే విధంగా వర్షపునీటి బిందువులు గోళాకార ఆకృతిని సంతరించుకొంటాయి. ఉష్ణోగ్రత పెరుగుదలతో బాటు ద్రవాల తలతన్యత తగ్గుతుంది.
c) స్నిగ్ధత : ఒక ద్రవం ప్రవహిస్తున్నపుడు ద్రవపు పొరలు ఒక దాని నుంచి ఇంకొకటి ముందుకు కదలడానికి ప్రయత్నిస్తాయి. ద్రవ ప్రవాహంలో పొరల మధ్య ఘర్షణ లేదా రాపిడివల్ల ద్రవప్రవాహాన్ని నిరోధించే కొలతనే స్నిగ్ధత అంటారు.
ఒక స్థిర ఘన ఉపరితలంపై ఒక ద్రవం ప్రవహిస్తున్నప్పుడు, ఉపరితలంపై ఉండే ద్రవపు పొరలోని అణువులు కదలిక లేక స్థిరంగా ఉంటాయి. తర్వాతి పొరలోని అణువులు కొద్దిగా కదులుతాయి. ఘన ఉపరితలం నుండి ఒక ద్రవపు పొర ఎంత దూరంగా ఉంటే, ఆ పొరలోని అణువులు అంత వేగంగా కదులుతాయి. ఈ విధంగా ఒక్కొక్క పొరలోని అణువులు వేరువేరు వేగాలతో ప్రయాణిస్తూ, ఒక క్రమ పద్ధతిలో వేగాల్లో భేదాలున్న ఈ పొరల ప్రవాహాన్ని దళ ప్రవాహం అంటారు. ప్రవహించే ద్రవంలో ఒక పొరను తీసుకొంటే దానిపైన ఉండే పొర మనం అనుకున్న పొర ప్రవాహాన్ని త్వరణం చెందిస్తే, దాని కింది పొర ప్రవాహ త్వరణాన్ని తగ్గిస్తుంది.
dz దూరంలో ఉన్న పొర వేగంలో మార్పు du అనుకుంటే ఆపొర వేగ ప్రవీణత \(\frac{d u}{d z}\) అవుతుంది. ద్రవపు పొరల ప్రవాహాన్ని నడపడానికి బలం కావాలి. ఈ బలం పొరల స్పర్శా వైశాల్యానికి పొర వేగ ప్రవీణతకు అనులోమానుపాతంలో ఉంటుంది.
F ∝ A. \(\frac{\mathrm{du}}{\mathrm{dz}}\)
⇒ F = η A \(\frac{d u}{d z}\)
η అనుపాత స్థిరాంకం. దీనిని స్నిగ్ధతా గుణకం అంటారు. ఏకాంక స్పర్శా వైశాల్యం, ఏకాంక వేగ ప్రవీణత గల ద్రవ ప్రవాహపు పొరపై పని చేసే బలాన్ని స్నిగ్ధతా గుణకం అంటారు.
SI ప్రమాణాలు NSm-2 లేదా పాస్కల్ సెకండ్ PaS η కు CGS ప్రమాణాలు పాయిస్.
ద్రవాల స్నిగ్ధత, ఉష్ణోగ్రతలో పెరుగుదలతో బాటు తగ్గుతుంది. దీనికి కారణం అధిక ఉష్ణోగ్రతల వద్ద ద్రవ అణువుల గతిజ శక్తి పెరిగి, అంతర అణుబలాలను అధిగమించి అణువులు ఒక పొర నుండి మరొక పొరలోకి తేలికగా జారిపోతుంటాయి.
లెక్కలు
ప్రశ్న 4.1.
30°C వద్ద 500 dm3 ఘనపరిమాణం 1 bar పీడనం గల గాలిని 200 dm3 ఘనపరిమాణానికి సంపీడనం చెందించడానికి కావలసిన కనిష్ఠ పీడనం ఎంత ?
సాధన:
నియమిత ఉష్ణోగ్రత నియమిత ద్రవ్యరాశి గల వాయువుకు బాయిల్ నియమం ప్రకారం
p1V1 = p2V2
V1 = 500 dm3 V2 = 200 dm3
p1 = 1 బార్ p2 = ?
1 × 500 = p2 × 200
P2 = \(\frac{500}{200}\) = 2.5 బార్
ప్రశ్న 4.2.
35°C 1.2 బార్ పీడనం వద్ద 120 mL ఘనపరిమాణం గల పాత్రలో కొంత వాయువు ఉన్నది. ఈ వాయువును 180 mL ఘనపరిమాణంగల పాత్రలోనికి మార్చినప్పుడు దాని పీడనం ఎంత ఉంటుంది ?
సాధన:
బాయిల్ నియమం ప్రకారం స్థిర ఉష్ణోగ్రత వద్ద
p1V1 = p2V2
p1 = 1.2 బార్ ; p2 = ?
V1 = 120 mL V2 = 180 mL
1.2 × 120 = p2 × 180
p2 = \(\frac{1.2 \times 120}{180}\) = \(\frac{1.2 \times 2}{3}\) = \(\frac{2.4}{3}\) = 0.8 బార్
ప్రశ్న 4.3.
pV = nRT స్థితి సమీకరణాన్ని ఉపయోగించి, ఇచ్చిన ఉష్ణోగ్రత వద్ద ఒక వాయువు సాంద్రత దాని పీడనానికి అనులోమానుపాతంలో ఉంటుందని చూపండి.
సాధన:
pV = nRT
\(\frac{\mathrm{n}}{\mathrm{V}}\) = \(\frac{\mathrm{p}}{\mathrm{RT}}\)
కాని n = \(\frac{\mathrm{m}}{\mathrm{M}}\)
∴ \(\frac{\mathrm{m}}{\mathrm{MV}}\) = \(\frac{\mathrm{m}}{\mathrm{MV}}\)
కాని \(\frac{\mathrm{m}}{\mathrm{V}}\) = d సాంద్రత
∴ \(\frac{\mathrm{d}}{\mathrm{M}}\) = \(\frac{\mathrm{p}}{\mathrm{RT}}\)
d = \(\frac{\mathrm{pM}}{\mathrm{RT}}\)
స్థిర ఉష్ణోగ్రత వద్ద \(\frac{\mathrm{M}}{\mathrm{RT}}\) స్థిరాంకం
d = స్థిరాంకం × p
∴ d ∝ p

ప్రశ్న 4.4.
0°C వద్ద 2 బార్ పీడనం వద్ద ఒక వాయువు ఆక్సైడ్ సాంద్రత, 5 బార్ పీడనం వద్ద డై నైట్రోజన్ సాంద్రతకు సమానమవుతుంది. ఆక్సైడ్ మోలార్ ద్రవ్యరాశి ఎంత ?
సాధన:
N2 సాంద్రత

ప్రశ్న 4.5.
27°C వద్ద 1 గ్రామ్ ఆదర్శ వాయువు A 2 బార్ పీడనం కలిగి ఉన్నది. అదే ఉష్ణోగ్రత వద్ద అదే పాత్రలోనికి 2g మరొక ఆదర్శవాయువు B ను పంపినపుడు పీడనం 3 బార్కు పెరిగింది. A, B వాయువుల మోలార్ ద్రవ్యరాశుల మధ్య సంబంధాన్ని కనుక్కోండి.
సాధన:
V = పాత్ర ఘనపరిమాణం
A ద్రవ్యరాశి = 1 గ్రా
సాంద్రత = \(\frac{1}{\mathrm{~V}}\) gm/Lit
B ద్రవ్యరాశి = 2 గ్రా.
సాంద్రత = \(\frac{2}{V}\)gm/Lit
మోలార్ ద్రవ్యరాశి M = \(\frac{\mathrm{dRT}}{\mathrm{P}}\)
వాయువులు ఒకే ఉష్ణోగ్రత వద్ద ఉన్నవి.
A యొక్క పాక్షిక పీడనం = 2 బార్
A యొక్క మోలార్ ద్రవ్యరాశి M
B యొక్క పాక్షిక పీడనం = 3 – 2 = 1 బార్
A యొక్క మోలార్ ద్రవ్యరాశి MA = \(\frac{1}{\mathrm{~V}} \cdot \frac{\mathrm{RT}}{2}\) = \(\frac{\mathrm{RT}}{2 \mathrm{~V}}\)
B యొక్క మోలార్ ద్రవ్యరాశి MB = \(\frac{2}{\mathrm{~V}} \cdot \frac{\mathrm{RT}}{1}\) = \(\frac{2 \mathrm{RT}}{\mathrm{V}}\)

ప్రశ్న 4.6.
డ్రైనేజ్లను శుభ్రపరిచే డ్రైనెక్స్ కొద్ది పాళ్లలో అల్యూమినియం కలిగి ఉండి కాస్టిక్ సోడాతో చర్య నొంది డైహైడ్రోజన్ ను ఇస్తుంది. 20°C 1 బార్ పీడనం వద్ద 0.15గ్రా అల్యూమినియం చర్యనొందిన, ఎంత ఘనపరిమాణం గల డైహైడ్రోజన్ విడుదలవుతుంది ?
సాధన:
రసాయన చర్య :

54 gల Al విడుదల చేసే హైడ్రోజన్ = 3 mol
0.15 ge Al విడుదలచేసే హైడ్రోజన్ = \(\frac{3 \times 0.15}{54}\) = 8.33 × 10-3 mol.
8.33 × 10-3 mol. మోల్ ల హైడ్రోజన్ ఘనపరిమాణం 20°C వద్ద 1 బార్ పీడనం వద్ద లెక్కించుట.
pV = nRT

ప్రశ్న 4.7.
27°C వద్ద 9 dm3 పాత్రలో 3.2 గ్రా మిథేన్, 4.4 గ్రా కార్బన్ డైఆక్సైడ్ కలిగి ఉన్న వాయు మిశ్రమం కలిగించే పీడనం ఎంత?
సాధన:
మిథేన్ మోల్ సంఖ్య = \(\frac{\mathrm{W}}{\mathrm{M}}\) = \(\frac{3.2}{16}\) = 0.2
CO2 మోల్ల సంఖ్య = \(\frac{4.4}{44}\) = 0.1
మొత్తం మోల్ల సంఖ్య = 0.2 + 0.1 = 0.3
మిశ్రమం పీడనం p = \(\frac{n R T}{V}\) = \(\frac{0.3 \times 0.083 \times 300}{9}\)
p = 0.83 బార్
0.83 బార్ = 0.83 × 1.013 × 105 = 8.31 × 104 Pa
ప్రశ్న 4.8.
27°C వద్ద 1L పాత్రలోనికి 0.8 బార్ పీడనం కలిగిన 0.5 L డైహైడ్రోజన్, 0.7 బార్ కలిగిన 2.0 L డైఆక్సిజన్ పంపినపుడు ఆ వాయు మిశ్రమం కలిగించే పీడనం ఎంత ?
సాధన:
1లీ పాత్రలోనికి పంపిన తరువాత హైడ్రోజన్ పీడనం :
p1V1 = p2V2
0.8 × 0.5 = p2 × 1
P2 = 0.4 బార్
ఆక్సిజన్ పీడనం
p1V1 = p2V2
0.7 × 2 = p2 × 1
మొత్తం పీడనం = పాక్షిక పీడనాల మొత్తం 0.4 + 1.4 = 1.8 బార్
ప్రశ్న 4.9.
27°C, 2 బార్ పీడనం వద్ద ఒక వాయువు సాంద్రత 5.46 g/dm3 ఉంటే, STP వద్ద దాని సాంద్రత ఎంత ?
సాధన:
M = \(\frac{\mathrm{dRT}}{\mathrm{p}}\) అని మనకు తెలియును
ఒకే వాయువుకు \(\frac{\mathrm{d}_1 \mathrm{~T}_1}{\mathrm{p}_1}\) = \(\frac{\mathrm{d}_2 \mathrm{~T}_2}{\mathrm{p}_2}\) అని వ్రాయవచ్చు
d1 = 5.46 g / dm3 d2 = ?
T1 = 300 k T2 = 273 K
P1 = 2 బార్ P2 = 1 బార్
\(\frac{\mathrm{d}_1 \mathrm{~T}_1}{\mathrm{p}_1}\) = \(\frac{\mathrm{d}_2 \mathrm{~T}_2}{\mathrm{p}_2}\)
d2 = \(\frac{\mathrm{d}_1 \mathrm{~T}_1 \mathrm{p}_2}{\mathrm{p}_1 \mathrm{~T}_2}\)
d2 = \(\frac{5.46 \times 300 \times 1}{2 \times 273}\)
= 2.998 = 3.0 g dm g-3
ప్రశ్న 4.10.
546°C, 0.1 బార్ పీడనం వద్ద 34.05 mL ఫాస్ఫరస్ బాష్పం భారం 0.0625 g ఉంటే, ఫాస్ఫరస్ మోలార్ ద్రవ్యరాశి ఎంత ?
సాధన:
pV = nRT
ఫాస్ఫరస్ బాష్పం మోల్ల సంఖ్య n = \(\frac{\mathrm{pV}}{\mathrm{RT}}\)

ఫాస్ఫరస్ మోలార్ ద్రవ్యరాశి M g mol-1
మోల్ల సంఖ్య = \(\frac{0.0625}{\mathrm{M}}\)
కాని m = \(\frac{0.0625}{\mathrm{M}}\) = 5 × 10-4
∴ m = \(\frac{0.0625}{5 \times 10^{-4}}\) = 125 g mol-1
ప్రశ్న 4.11.
27°C వద్ద ప్రయోగం చేసేటప్పుడు ఒక విద్యార్థి పాత్రలో చర్యా మిశ్రమాన్ని తీసుకోవడం మర్చిపోయి, పాత్రను వేడి చేస్తున్నాడు. కొంత సమయానికి తప్పు తెలుసుకొని పాత్ర ఉష్ణోగ్రతను పైరో మీటర్ ద్వారా చూస్తే, ఉష్ణోగ్రత 477 °C ఉన్నది. ఎంత భాగం గాలి బయటకు పోయిందో లెక్కకట్టండి.
సాధన:
పాత్ర ఘనపరిమాణం V ml.
T1 = 27 + 273 = 300K
T2 = 477 + 273 = 750 K
ఛార్లెస్ నియమం ప్రకారం
\(\frac{\mathrm{V}_1}{\mathrm{~T}_1}\) = \(\frac{V_2}{T_2}\)
V2 = \(\frac{\mathrm{V}_1 \mathrm{~T}_2}{\mathrm{~T}_1}\) = \(\frac{\mathrm{V} \times 750}{300}\) = 2.5V
750K వద్ద బయటకు పోయిన గాలి = 2.5 V – V = 1.5 V
బయటకు పోయిన గాలి భాగం = \(\frac{1.5 \mathrm{~V}}{2.5 \mathrm{~V}}\) = \(\frac{3}{5}\) = 0.6
ప్రశ్న 4.12.
3.32 బార్ పీడనం వద్ద 4.0 మోల్ల వాయువు 5dm3 ఘనపరిమాణం ఆక్రమించిన, ఆ వాయువు ఉష్ణోగ్రతను లెక్కకట్టండి. (R = 0.083 బార్ dm3 K-1 mol-1).
సాధన:
pV = nRT
T = \(\frac{p V}{n R}\)
p = 3.32 బార్ V = 5 dm3
n = 4.0 R = 0.083
ఈ విలువలను ప్రతిక్షేపిస్తే

ప్రశ్న 4.13.
1.4g డైనైట్రోజన్ వాయువులో ఉన్న మొత్తం ఎలక్ట్రాన్ల సంఖ్యను లెక్క కట్టండి.
సాధన:
ప్రతి N2 అణువులోను 14 ఎలక్ట్రానులుంటాయి.
నైట్రోజన్ అణువుల సంఖ్య = \(\frac{1.4}{28}\) × 6.023 × 1023
ఎలక్ట్రానుల సంఖ్య = \(\frac{1.4}{28}\) × 6.023 × 1023 × 14 = 4.215 × 1023
ప్రశ్న 4.14.
ప్రతి సెకనుకు 1010 ధాన్యపు గింజలను పంచుకుంటూ పోతే అవొగాడ్రో సంఖ్య ధాన్యపు గింజలను పంచటానికి గింజలను పంచటానికి ఎంత కాలం పడుతుంది ?
సాధన:
1010 ధాన్యపు గింజలను పంచడానికి కాలం = 1 సె.
6.023 × 1023 ధాన్యపు గింజలను పంచడానికి కాలం = ?
= \(\frac{6.0^{23} \times 10^{23}}{10^{10}}\) = 6.023 × 1013 సెకన్లు
= 1.909 × 106 సంవత్సరాలు.

ప్రశ్న 4.15.
ఒక సన్నని రంధ్రం గుండా అమ్మోనియా వాయువు వ్యాపనం రేటు 0.5 lit min-1. అదే పరిస్థితులలో క్లోరిన్ వాయువు వ్యాపనం రేటు ఎంత ?
సాధన:
రెండు వాయువుల వ్యాపన రేట్లు r1, r2, అణుభారాలు వరుసగా M1, M2 అయితే

ప్రశ్న 4.16.
CO2, Cl2 వాయువుల సాపేక్ష వ్యాపనం రేట్లు కనుక్కోండి.
సాధన:

ప్రశ్న 4.17.
150 mL కార్బన్ మోనాక్సైడ్ నిస్సరణం చెందడానికి 25 సె॥కాలం పడితే అదే కాలంలో ఎంత ఘనపరిమాణం గల మిథేన్ వాయువు నిస్సరణం చెందుతుంది ?
సాధన:


25 సె॥ వ్యాపనం చెందిన మిథేన్ 198.5 mL.

ప్రశ్న 4.18.
ఒక 100 మీటర్ల గొట్టంలోకి ‘A’ వైపు నుంచి హైడ్రోజన్ క్లోరైడ్, ‘B’ వైపు నుంచి అమ్మోనియా వాయువును ఒకే పరిస్థితులలో పంపితే, ‘A’ నుంచి ఎంత దూరంలో రెండు వాయువులు కలుసుకొంటాయి ?
సాధన:
హైడ్రోజన్ క్లోరైడ్ ప్రయాణించిన దూరం = x
అమ్మోనియా ప్రయాణించిన దూరం = 100 – x
ప్రయాణించే దూరం వ్యాపన రేటుకు అనులోమానుపాతంలో ఉంటుంది.

దీనిని సాధించగా x = 40.48 మీటరు. A వైపు నుండి 40.48 మీటర్ల దూరంలో రెండు వాయువులు కలుసుకుంటాయి.
ప్రశ్న 4.19.
27°C వద్ద 1 dm3 పాత్రలో ఉన్న 8గ్రా. డైఆక్సిజన్, 4గ్రా. డైహైడ్రోజన్ వాయువుల మిశ్రమం కలిగించే పీడనాన్ని లెక్కించండి. [R = 0.083 బార్ dm3 K-1 mol-1]
సాధన:
హైడ్రోజన్ మోత్ల సంఖ్య = \(\frac{4}{2}\) = 2.0 మోల్
ఆక్సిజన్ మోల్ సంఖ్య = \(\frac{8}{16}\) = 0.5 మోల్
మొత్తం మోల్ల సంఖ్య = 2.0 + 0.5 = 2.5 మోల్
pV = nRT

ప్రశ్న 4.20.
27°C వద్ద 5dm3 పాత్రలో ఉన్న 3.5గ్రా.డైనైట్రోజన్, 3.0గ్రా. డైహైడ్రోజన్, 8.0 గ్రా డైఆక్సిజన్ వాయువుల మిశ్రమం కలిగించే మొత్తం పీడనాన్ని కనుక్కోండి. (R = 0.083 బార్dm3K-1mol-1)
సాధన:
నైట్రోజన్ మోల్ ల సంఖ్య = \(\frac{3.5}{28}\) = 0.125
హైడ్రోజన్ మోల్ ల సంఖ్య = \(\frac{3.0}{2}\) = 1.5
ఆక్సిజన్ మోల్ల సంఖ్య = \(\frac{8.0}{32}\) = 0.25
మొత్తం మోత్ల సంఖ్య = 0.125 + 1.5 + 0.25 = 1.875
ఆదర్శవాయు సమీకరణం pV = nRT
p = \(\frac{\mathrm{nRT}}{\mathrm{V}}\) = \(\frac{1.875 \mathrm{~mol} \times 0.083 \times 300 \mathrm{k}}{5 \mathrm{dm}^3}\)
p = 9.33 బార్
ప్రశ్న 4.21.
స్థాన భ్రంశం చెందిన గాలి ద్రవ్యరాశి, బెలూన్ ద్రవ్యరాశుల మధ్య బేధాన్ని పేలోడ్ గా వ్యవహరిస్తారు. 27°C, 11.6 బార్ పీడనం వద్ద 10 మీ వ్యాసార్ధం, 100 kg ద్రవ్యరాశి గల, బెలూను హీలియం వాయువుతో నింపినప్పుడు ఒక బెలూన్ పేలోడ్ను లెక్కించండి. (గాలి సాంద్రత 1.2 kgm-3, R = 0.083 బార్ dm3‘K-1‘mol-1).
సాధన:
బెలూన్ ఘనపరిమాణం = \(\frac{4}{3} \pi r^3\) = \(\frac{4}{3}\)π(10)3 = 4190.47 m3
స్థానభ్రంశం చెందే గాలి భారం = సాంద్రత × ఘనపరిమాణం

హీలియం భారం = 279364.6 × 4g = 1117.45 kg
బెలూన్ పే లోడ్ = గాలి భారం – He భారం – బెలూన్ భారం
= 5028.5 – 1117.45 100 = 3811.1 kg
= 279364.6 mol.
ప్రశ్న 4.22.
31.1°C, 1 బార్ పీడనం వద్ద 8.8 g CO2 వాయువు ఆక్రమించే ఘనపరిమాణాన్ని లెక్కించండి. (R = 0.083 బార్ LK-1mol-1).
సాధన:
CO2 మోల్ల సంఖ్య = \(\frac{8.8}{44}\) = 0.2
R = 0.083 బార్ Lk-1mol-1
T = 273 + 31.1 = 304.1 K
P = 1 బార్

ప్రశ్న 4.23.
95°C వద్ద 2.9 g ద్రవ్యరాశిగల ఒక వాయువు ఆక్రమించే ఘనపరిమాణం, అదే పీడనం వద్ద 17°C వద్ద 0. 184 g డైహైడ్రోజన్ ఆక్రమించే ఘనపరిమాణానికి సమానం. అయితే వాయువు మోలార్ ద్రవ్యరాశి ఎంత ?
సాధన:
వాయువు మోల్ ల సంఖ్య = \(\frac{2.9}{\mathrm{~m}}\)
p1V1 = nRT1
p1 V1 = \(\frac{2.9}{\mathrm{~m}}\) . R . (95 + 273)
p1 V1 = \(\frac{2.9}{\mathrm{~m}}\) . R . 368
హైడ్రోజన్కు
హైడ్రోజన్ మోత్ల సంఖ్య = \(\frac{0.184}{2}\)
P2 V2 = \(\frac{0.184}{2}\).R.(17 + 273)
P2 V2 = \(\frac{0.184}{2}\).R.(290)
వాయువు పీడన, ఘనపరిమాణాలు సమానం.
p1V1 = p2 V2

ప్రశ్న 4.24.
1 బార్ పీడనం వద్ద డైహైడ్రోజన్, ఆక్సిజన్ వాయువుల మిశ్రమంలో డైహైడ్రోజన్ భారశాతం 20% అయినా, డైహైడ్రోజన్ పాక్షిక పీడనాన్ని లెక్కించండి.
సాధన:
మొత్తం భారం = 1గ్రా. అనుకొనుము.
హైడ్రోజన్ భారం = 0.2 గ్రా.
మోల్ల సంఖ్య = \(\frac{0.2}{2}\) = 0.1
ఆక్సిజన్ మోల్ల సంఖ్య = \(\frac{0.8}{32}\) = 0.025
హైడ్రోజన్ మోల్ భాగం = \(\frac{0.1}{0.125}\) = 0.8
హైడ్రోజన్ పాక్షిక పీడనం = మొత్తం పీడనం × H2 మోల్భాగం
= 1 బార్ × 0.8 = 0.8 బార్
ప్రశ్న 4.25.
pV2T2/n విలువకు SI ప్రమాణం ఏమిటి ?
సాధన:
pV = nRT
p = \(\frac{\mathrm{nRT}}{\mathrm{V}}\)
\(\frac{p V^2 \mathrm{~T}^2}{\mathrm{n}}\) = \(\frac{\mathrm{nRT}}{\mathrm{V}}\) . V2 . T2 = RT3V
S.I. ప్రమాణాలు జౌల్. K-1 mol-1 . K3. m3 = జౌల్ . m3. K2 mol-1.
ప్రశ్న 4.26.
ఛార్లెస్ నియమం ప్రకారం – 273°C ను అత్యల్ప ఉష్ణోగ్రతగా ఎందుకు భావిస్తారో వివరించండి.
సాధన:
ఇవ్వబడిన పీడనం వద్ద వాయువుల ఘనపరిమాణ ఉష్ణోగ్రత రేఖలు సరళరేఖలుగా ఉండి, వాటిని పొడిగించినపుడు ఉష్ణోగ్రత అక్షాన్ని -273. 15°C వద్ద ఖండిస్తాయి. శూన్య ఘనపరిమాణం వద్ద అన్ని రేఖలు -273.15°C వద్ద కలుస్తాయి. -273.15°C ఉష్ణోగ్రత వద్ద వాయువుల ఘనపరిమాణం శూన్యమవుతుంది. అంటే వాయువుల ఉనికి లేకుండా పోతుంది. నిజానికి ఈ ఉష్ణోగ్రతకు రాకముందే అన్ని వాయువులు ద్రవాలుగా మారతాయి. వాయువులు శూన్య ఘనపరిమాణం కలిగి ఉండే కనిష్ఠ ఉష్ణోగ్రత – 273.15°C. ఈ ఉష్ణోగ్రతను పరమ శూన్య ఉష్ణోగ్రతగా భావిస్తారు. ఇదే కనిష్ఠ ఉష్ణోగ్రత.

ప్రశ్న 4.27.
కార్బన్ డై ఆక్సైడ్, మీథేన్ల సందిగ్ధ ఉష్ణోగ్రతలు వరుసగా 31.1°C, – 81.9°C అయినా, వీటిలో ఏ వాయువులో బలమైన అంతర అణు ఆకర్షణ బలాలుంటాయి ?
సాధన:
వాయువు సందిగ్ధ ఉష్ణోగ్రత ఎక్కువగా ఉంటే అంతర అణుబలాలు బలంగా ఉంటాయి. అటువంటి వాటిని సులభంగా ద్రవీకరణం చెందించవచ్చు.
CO2 సందిగ్ధ ఉష్ణోగ్రత (31.1°C) మిథేన్ సందిగ్ధ ఉష్ణోగ్రత కన్నా ఎక్కువ. అందువల్ల CO2 లో అంతర అణు ఆకర్షణ బలాలు బలంగా వుంటాయి.

ప్రశ్న 4.28.
గాలిని 25°C నుండి 0°C కు చల్లబరిచిన, అణువుల rms వేగంలో కలిగే తగ్గుదలను లెక్కించండి.
సాధన:

ప్రశ్న 4.29.
27°C వద్ద SO2 వాయువు RMS వేగం, సగటు వేగం, గరిష్ఠ సంభావ్యతా వేగాలను కనుక్కోండి.
సాధన:
T = 27 + 273 = 300 K
R = 8.314 J mol-1 K-1
M = SO2 ద్రవ్యరాశి = 64g/mol-1
RMS వేగం urms = \(\sqrt{\frac{3 R T}{M}}\)
1 Joule = kg m2 s-2

= 3.42 × 102 ms-1
సగటు వేగం
uav = 0.9213 × urms
= 3.42 × 102 × 0.9213
= 3.15 × 102 ms-1
గరిష్ఠ సంభావ్యతా వేగం = ump
ump = 0.8166 × urms
= 0.8166 × 3.42 × 102 = 2.79 × 102 ms-1
ప్రశ్న 4.30.
27°C వద్ద O2 RMS, సగటు, గరిష్ఠ సంభావ్యతా వేగాలను కనుక్కోండి.
సాధన:
T = 27 + 273 = 300K
R = 8.314 JK-1 mol-1
M = O2 ద్రవ్యరాశి = 32 g/mol
1 Joule = Kg m2s-2

urms = 4.614 × 102 ms-1
సగటు వేగం = 0.9213 × 4.614 × 102 = 4.25 × 102 ms-1
గరిష్ఠ సంభావ్యతా వేగం = 0.8166 × 4.614 × 102/sup> = 3.77 × 102 m.s-1
అదనపు లెక్కలు ప్రశ్నలు
ప్రశ్న 4.31.
27°C వద్ద CO2 వాయువు RMS, సగటు గరిష్ట సంభావ్యతా వేగాలను కనుక్కోండి.
సాధన:
T = 27 + 273 = 300K
R = 8.314 J mol-1 K-1
M = CO2 ద్రవ్యరాశి = 44g mol-1
1J = kg m2 s-2

సగటు వేగం uav = 0.9213 × RMS వేగం
= 0.9213 × 4.12 × 102 ms-1 = 3.8 × 102 ms-1
గరిష్ఠ సంభావ్యతా వేగం
ump = 0.8166 × 4.12 × 102 ms-1 = 3.36 × 102 ms-1
ప్రశ్న 4.32.
27°C వద్ద 5 మోల్ల నైట్రోజన్ వాయువు గతిజశక్తిని కనుక్కోండి. (March 2013)
సాధన:
గతిజశక్తి = \(\frac{3}{2}\)nRT
n = 5 moles, R = 8.314 J mol-1K-1
T = 27 + 273 = 300K
గతిజశక్తి = \(\frac{3}{2}\) × 5 mol × 8.314 J mol-1K-1 × 300 K = 18,706.5 J
ప్రశ్న 4.33.
-73°C వద్ద 4g మిథేన్ గతిజశక్తిని కనుక్కోండి.
సాధన:
n = మిథేన్ మోల్ల సంఖ్య = \(\frac{4 g}{16 g \mathrm{mn}^{-1}}\) = 0.25 mol
R = 8.314 J mol-1 K-1
T = -73°C + 273 = 200K
గతిజశక్తి Ek = \(\frac{3}{2}\) nRT
= \(\frac{3}{2}\) × 0.25 mol × 8.314 J mol-1 K-1 × 200K = 623.6 J
ప్రశ్న 4.34.
ఒకే ఉష్ణోగ్రత వద్ద 3g H2, 4g O2 వాయువుల గతిజశక్తి నిష్పత్తిని లెక్కకట్టండి.
సాధన:
హైడ్రోజన్ మోల్ల సంఖ్య = \(\frac{3}{2}\)
ఆక్సిజన్ మోల్ల సంఖ్య = \(\frac{4}{32}\) = \(\frac{1}{8}\)
రెండు వాయువులు ఒకే ఉష్ణోగ్రత వద్ద ఉన్నందున గతిజ శక్తుల నిష్పత్తి మోల్ సంఖ్యల నిష్పత్తికి సమానం.
H2 మోల్ : O2 మోల్ = \(\frac{3}{2}\) : \(\frac{1}{8}\) = 12 : 1
ప్రశ్న 4.35.
ఒక బెలూన్ గది ఉష్ణోగ్రత వద్ద హైడ్రోజన్ వాయువుతో నింపారు. పీడనం 0.2 బార్ కంటే ఎక్కువయితే బెలూన్ పగిలిపోతుంది. 1 బార్ పీడనం వద్ద వాయువు ఆక్రమించే ఘనపరిమాణం 2.27L అయితే ఎంత ఘనపరిమాణం వరకు బెలూను వ్యాకోచింప చేయవచ్చు ?
సాధన:
బాయిల్ నియమం ప్రకారం p1V1 = p2V2
p1 = 1 బార్ అయితే V1 = 2.27 L
p2 = 0.2 బార్ అయితే V2 = \(\frac{p_1 V_1}{p_2}\)
⇒

0.2 బార్ పీడనం వద్ద బెలూన్ పగిలిపోతుంది. కాబట్టి బెలూన్ ఘనపరిమాణం 11.35 కంటే తక్కువ ఉంచాలి.
ప్రశ్న 4.36.
23.4°C వద్ద పసిఫిక్ మహాసముద్రంలో ప్రయాణిస్తున్న ఓడలో 2L గాలితో నింపిన బెలూన్ ఉంది. ఆ ఓడ 26.1°C ఉష్ణోగ్రత వద్ద ఉన్న హిందూ మహాసముద్రం చేరుకున్నపుడు బెలూన్ ఘనపరిమాణం ఎంత ఉంటుంది ?
సాధన:
V1 = 2L T2 = 26.1 + 273 = 299.1 K
T1 = 23.4 + 273 = 296.4 K
ఛార్లెస్ నియమం ప్రకారం
\(\frac{\mathrm{V}_1}{\mathrm{~T}_1}\) = \(\frac{\mathrm{V}_2}{\mathrm{~T}_2}\)
⇒ V2 = \(\frac{\mathrm{V}_1 \mathrm{~T}_2}{\mathrm{~T}}\) = \(\frac{2 \mathrm{~L} \times 299 \mathrm{~K}}{296.4 \mathrm{~K}}\) = 2L × 1.009 = 2.018 L
ప్రశ్న 4.37.
25°C, 760 mm పాదరస పీడనం వద్ద ఒక వాయువు 600 మి.లీ. ఘనపరిమాణం ఆక్రమిస్తుంది. ఉష్ణోగ్రత 10°C వద్ద దాని ఘనపరిమాణం 640 మి.లీ. ఉంటే, ఆ వాయువు పీడనం ఎంత ?
సాధన:
p1 = 760 mm V1 = 600 mL
T1 = 25 + 273 = 298
V2 = 640 mL T2 = 10 + 273 = 283 K
సంయుక్త వాయు నియమం ప్రకారం

ప్రశ్న 4.38.
360 cm3 మిథేన్ వాయువు 15ని॥ ఒక సచ్ఛిద్ర పాత్ర నుండి వ్యాపనం చెందింది. అదే పరిస్థితుల్లో 120 cm3 ఒక వాయువు 10 ని॥ వ్యాపనం చెందినట్లయితే ఆ వాయువు మోలార్ ద్రవ్యరాశి కనుక్కోండి.
సాధన:
మీథేన్ వాయువు వ్యాపన రేటు

మిథేన్ మోలార్ ద్రవ్యరాశి = 16 g mol-1
రెండో వాయువు వ్యాపన రేటు :

వాయువు మోలార్ ద్రవ్యరాశి M2 = ?
గ్రాహం వాయు వ్యాపన నియమం ప్రకారం

ఇరువైపులా వర్గం చేయగా
M2 = \(\frac{24 \times 24 \times 16}{12 \times 12}\) = 64
వాయువు మోలార్ ద్రవ్యరాశి = 64 g mol-1
ప్రశ్న 4.39.
కార్బన్ డైఆక్సైడ్, మరొక వాయువు ‘X’ ల వ్యాపన రేట్లు వరుసగా 0.290 ccs-1, 0.271 ccs-1 అయితే ‘X’ వాయువు బాష్పసాంద్రత కనుక్కోండి. CO2 బాష్ప సాంద్రత 22.
సాధన:

ప్రశ్న 4.40.
70.6గ్రా. డైఆక్సిజన్, 167.5 గ్రా. నియాన్ వాయువులు గల వాయు మిశ్రమం కలుగచేసే పీడనం 25 బార్. అయితే డైఆక్సిజన్, నియాన్ వాయువుల పీడనాలను కనుక్కోండి.
సాధన:
డైఆక్సిజన్ (O2) మోల్ల సంఖ్య = \(\frac{70.6 \mathrm{~g}}{32 \mathrm{~g} \mathrm{~mol}^{-1}}\) = నియాన్ (Ne) మోత్ల సంఖ్య = \(\frac{167.5 \mathrm{~g}}{20 \mathrm{~g} \mathrm{~mol}^{-1}}\) = 8.375 mol
డైఆక్సిజన్ మోల్ భాగం = \(\frac{2.21}{2.21+8.375}\) = \(\frac{2.21}{10.585}\) = 0.21
నియాన్ మోల్ భాగం = \(\frac{8.375}{10.585}\) = 0.79
పాక్షిక పీడనం = మోల్ భాగం × వాయు మిశ్రమం మొత్తం పీడనం
ఆక్సిజన్ పాక్షిక పీడనం = 0.21 × 25 = 5.25 బార్
నియాన్ పాక్షిక పీడనం = 0.79 × 25 = 19.75 బార్
ప్రశ్న 4.41.
ఐసోకోర్లు అంటే ఏమిటి ? అవి ఏ విధంగా వుంటాయి ?
సాధన:
స్థిర మోలార్ ఘనపరిమాణంగల వాయువు పీడన – ఉష్ణోగ్రత రేఖలను ‘ఐసోకోర్లు’ అంటారు.

ఈ రేఖా పటంలో V1 < V2 < V3
ప్రశ్న 4.42.
సంయుక్త వాయు నియమాన్ని వ్రాయండి.
సాధన:
నియమిత ద్రవ్యరాశిగల ఒక వాయువు తొలి పీడనం ఘనపరిమాణం, పరమ ఉష్ణోగ్రతలు p1, T1, V1 అయితే తుది పీడనం, ఘనపరిమాణం, పరమ ఉష్ణోగ్రతలు p2, V2, T2 అయితే
⇒ \(\frac{\mathrm{p}_1 \mathrm{~V}_1}{\mathrm{~T}_1}\) = \(\frac{\mathrm{p}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
ఈ సమీకరణంలోని ఆరు చక్రాంకాలలో ఏ ఐదు తెలిసినా ఆరోదాని విలువను గణించవచ్చు.
ఈ సమీకరణాన్ని సంయుక్త సమీకరణం అంటారు.

ప్రశ్న 4.43.
అణువేగాలపై ఉష్ణోగ్రతా ప్రభావం ఏమిటి ?
సాధన:
అణువేగాల పంపిణీ – ఉష్ణోగ్రతల వద్ద అణువుల సంఖ్యకు, అణువులవేగాలకు మధ్య గీసిన వక్రరేఖలు సూచించబడినాయి. ఈ వక్రరేఖల ద్వారా అత్యధికవేగం, అత్యల్పవేగం గల అణువుల సంఖ్య అత్యల్పమని తెలుస్తుంది. ఉష్ణోగ్రత పెరిగే కొద్దీ వక్రరేఖ వెడల్పు పెరుగుతుంది. అంటే అధిక ఉష్ణోగ్రతల వద్ద ఎక్కువ వేగాలు ఉన్న అణువుల సంఖ్య పెరుగుతుంది. అధిక ఉష్ణోగ్రత వద్ద వాయువుకు గల అన్నివేగాలూ పెరుగుతాయి. ఉష్ణోగ్రత పెంచితే గరిష్ఠ సంభావ్యతా వేగం, RMS వేగం, మరియు సరాసరి వేగాలు పెరుగుతాయి.

ప్రశ్న 4.44.
అమ్మోనియా, కార్బన్ డైఆక్సైడ్, వాయువుల సందిగ్ధ ఉష్ణోగ్రతలు వరుసగా 405.5K, 304.1K, 500K నుండి సందిగ్ధ ఉష్ణోగ్రతకు చల్లబరిచినపుడు వీటిలో ఏ వాయువు ముందుగా ద్రవీకరించబడుతుంది ?
సాధన:
అమ్మోనియా వాయువు ముందుగా ద్రవీకరించబడుతుంది. దీనికి కారణం దాని సందిగ్ధ ఉష్ణోగ్రత ముందుగా వస్తుంది.
CO2 ద్రవీకరణకు అధిక చల్లదనం అవసరం.
ప్రశ్న 4.45.
బాయిల్ నియమాన్ని రేఖా పటం ద్వారా ఎలా చూపుతారు ?
సాధన:
బాయిల్ నియామాన్ని p – V సమోష్ణోగ్రతా రేఖల ద్వారా చూపవచ్చు. స్థిర ఉష్ణోగ్రత వద్ద p – V వక్రరేఖలు క్రింద చూపిన విధంగా వుంటాయి.

P, \(\frac{1}{V}\) గ్రాఫులు సరళరేఖలు. అధిక పీడనాల వద్ద వాయువులు బాయిల్ నియమాన్ని పాటించవు. కాబట్టి అధిక పీడనాల వద్ద P, \(\frac{1}{V}\) ల మధ్య గ్రాఫ్ సరళరేఖగా ఉండదు.
ప్రశ్న 4.46.
స్థిర ఉష్ణోగ్రత వద్ద వాయు పీడనానికి, సాంద్రతకుగల సంబంధాన్ని తెలపండి.
సాధన:
బాయిల్ నియమం ప్రకారం p = k. \(\frac{1}{v}\)
కాని వాయు సాంద్రత d = \(\frac{m}{v}\)
లేదా \(\frac{1}{v}\) = \(\frac{d}{m}\)
∴ p = k. \(\frac{d}{m}\) [\(\frac{k}{m}\) స్థిరాంకం]
∴ p ∝ d
స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశిగల వాయువు పీడనం దాని సాంద్రతకు అనులోమానుపాతంలో ఉంటుంది.
ప్రశ్న 4.47.
వేసవి కాలంలో టైర్లలోని గాలిపీడనం అనూహ్యంగా పెరిగి, టైరు పగిలి పోతుంది. ఎందువల్ల ?
సాధన:
గేలూసాక్ నియమం ప్రకారం స్థిర ఘనపరిమాణం వద్ద నియమిత ద్రవ్యరాశిగల వాయువు పీడనం పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.
p ∝ T
⇒ \(\frac{\mathrm{p}}{\mathrm{T}}\) = స్థిరాంకం
వేసవి కాలంలో ఉష్ణోగ్రత పెరగడంవల్ల టైర్లలోని గాలి పీడనం పెరిగి టైరు పగిలి పోతుంది.
![]()
![]()
![]()


![]()
![]()


![]()


![]()