Telangana TSBIE TS Inter 1st Year Chemistry Study Material 3rd Lesson రసాయన బంధం – అణు నిర్మాణం Textbook Questions and Answers.
TS Inter 1st Year Chemistry Study Material 3rd Lesson రసాయన బంధం – అణు నిర్మాణం
అత్యంత లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 1.
అష్టక నియమం అంటే ఏమిటి?
జవాబు:
పరమాణువులు ఎలక్ట్రాన్లను కోల్పోవడం, స్వీకరించడం లేదా పంచుకోవడం ద్వారా వాటి వేలన్స్ కర్పరంలో ఎనిమిది ఎలక్ట్రాన్లు పొందటానికి ప్రయత్నిస్తాయి. దీనినే అష్టక నియమం అంటారు. కొస్సెల్, లూయీలు ఈ సిద్ధాంతాన్ని ప్రవేశపెట్టారు.
ప్రశ్న 2.
S, S2- లకు లూయీ ఎలక్ట్రాన్ చుక్కల సంకేతాలు రాయండి.
జవాబు:
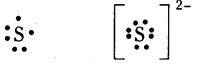
![]()
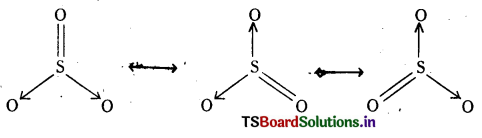
ప్రశ్న 3.
SO3 కి వీలయినన్ని రెజోనెన్స్ నిర్మాణాలు రాయండి.
జవాబు:
ప్రశ్న 4.
AlCl3 + Cl– →AlC\(l_4^{-}\) చర్యలో Al పరమాణువు సంకరీకరణంలో మార్పు ఏమైనా ఉంటే ఊహించి రాయండి.
జవాబు:
AlCl౩ అణువు ఏర్పడేటప్పుడు కేంద్రక ‘Al’ పరమాణువు దాని 1వ ఉత్తేజిత’.
స్థితిలో (1s2 2s2 2p6 3s1 3p2sp2) సంకరీకరణం పొందుతుంది. అపుడు దానిపై మూడు sp2 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటన్నింటిలో బంధ ఎలక్ట్రాన్లు ఉంటాయి. మూడు సంకర sp2 ఆర్బిటాళ్ళు మూడు Cl పరమాణువుల 3pz ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసికొని మూడు సిగ్మా బంధాలను ఇస్తాయి. కేంద్రక ‘Al’ పరమాణువు sp2 సంకరీకరణం పొందడం వల్ల AlCl3 అణువు సమతల త్రిభుజాకృతిని కలిగి ఉంటుంది.
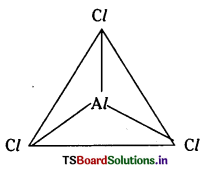
AlCl3 లో కేంద్రక ‘Al’ పరమాణువు మీద ఖాళీగా Pz ఆర్బిటాల్ ఉంటుంది.
Cl– అయాన్ విన్యాసం = 1s22s22p63s23p6
AlCl3 అణువు Cl– అయాన్ తో చర్య జరిపేటపుడు “Al” పరమాణువు తన sp2 సంకరీకరణాన్ని sp3 సంకరీకరణంగా మార్చుకుంటుంది. అట్లేర్పడ్డ నాలుగు sp3 సంకర ఆర్బిటాళ్లలో మూడింటిలో బంధ జంటలు ఉండగా ఒక sp3 ఆర్బిటాల్ మాత్రం ఖాళీగా ఉంటుంది. బంధ జంటలు గల మూడు sp3 సంకర ఆర్బిటాళ్ళు మూడు ‘C’ పరమాణువుల 3pz, ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకొని మూడు సిగ్మా బంధాలను ఇస్తాయి. ఇపుడు కేంద్రక ‘Al’ పరమాణువులోని ఖాళీగా ఉన్న నాల్గవ sp3 సంకర ఆర్బిటాల్ Cl– అయాన్ నుండి ఒక జత ఎలక్ట్రాన్ను స్వీకరించి సమన్వయ సమయోజనీయ బంధం ఏర్పరచుకుంటుంది. ఈ విధంగా AlC\(l_4^{-}\) లో కేంద్రక ‘Al’ పరమాణువు sp3 సంకరీకరణం పొందడం వల్ల AlC\(l_4^{-}\), టెట్రాహెడ్రల్ ఆకృతి ఏర్పడుతుంది.
AlCl3 నుండి AlC\(l_4^{-}\) మారినపుడు అల్యూమినియంలో సంకరీకరణం sp2 నుండి sp3 కి మారుతుంది.
ప్రశ్న 5.
Ca2+, Zn2+ లలో ఏది స్థిరమైనది ? ఎందువల్ల ?
జవాబు:
1) Ca2+ అయాను Zn2+ అయాను కంటె అధిక స్థిరమైనది.
కారణం : మిధ్యా జడవాయు ఎలక్ట్రాన్ విన్యాసం వల్ల ఉన్న అయాను కన్న జడవాయు ఎలక్ట్రాన్ విన్యాసం ఉన అయాను స్థిరమైనది.
Ca2+ (2, 8, 8) కు జడవాయు ఎలక్ట్రాన్ విన్యాసం ఉంది. అనగా బాహ్య కర్పరంలో ఎనిమిది ఎలక్ట్రాన్లు ఉన్నాయి అందువల్ల స్థిరమైనది.
Zn2+ (2, 8, 18) బాహ్య కర్పరంలో 18 ఎలక్ట్రాన్లు ఉన్నాయి. ఇది మిధ్యా జడవాయు ఎలక్ట్రాన్ విన్యాసం.
ప్రశ్న 6.
CI అయాను CI పరమాణువు కంటే స్థిరమైనది. ఎందువల్ల ?
జవాబు:
ns2 np6 ఎలక్ట్రాన్ విన్యాసం గల పరమాణువు లేదా అయాను స్థిరమైనది. Cl– కు స్థిర ఎలక్ట్రాన్ విన్యాసం కలదు.
Cl (Z) = 17 ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p6 3s2 3p5
Cl– ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p6 3s2 3p6
అందువల్ల Cl కన్నా Cl– అయాను స్థిరమైనది.
![]()
ప్రశ్న 7.
ఆర్గానన్ను Ar, గా ఎందుకు రాయకూడదు ?
జవాబు:
Ar ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p6 3s2 3p6.
Ar పరమాణువుకు స్థిరమైన ఎలక్ట్రాన్ విన్యాసం ఉండుట వలన అది బంధంలో పాల్గొనదు. Ar2 ఏర్పడదు.
ప్రశ్న 8.
హైడ్రోజన్ సల్ఫైడ్ కంటే నీటి బాష్పీభవన స్థానం ఎక్కువ. ఎందువల్ల ?
జవాబు:
నీటియందు హైడ్రోజన్ బంధాల వల్ల అది సహచరిత ద్రవం. నీటి అణువుల మధ్య గల అనేక అంతర అణు హైడ్రోజన్ బంధాలను ఛేదించుటకు అధిక శక్తి అవసరం. అందువల్ల నీరు ద్రవస్థితి నుంచి బాష్పస్థితికి మారడానికి అధిక ఉష్ణోగ్రత అవసరం.
హైడ్రోజన్ సల్ఫైడ్ అణువుల మధ్య హైడ్రోజన్ బంధాలు లేవు. వాటి మధ్య బలహీన వాండర్ వాల్ బలాలు మాత్రమే ఉంటాయి. అందువల్ల H2S బాష్పీభవన స్థానం తక్కువ.
ప్రశ్న 9.
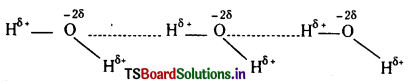
నీటి బాష్పీభవన స్థానం హైడ్రోజన్ ఫ్లోరైడ్ బాష్పీభవన స్థానం కంటే ఎక్కువ. ఎందువల్ల ?
జవాబు:
నీటి అణువుల మధ్య ఉన్న హైడ్రోజన్ బంధాలు హైడ్రోజన్ ఫ్లోరైడ్ అణువుల మధ్య ఉన్న హైడ్రోజన్ బంధాల కన్న రెట్టింపు. అందువల్ల బాష్పీభవన స్థానం ఎక్కువ. HF లోని హైడ్రోజన్ బంధాలు నీటిలోని హైడ్రోజన్ బంధాల కన్నా . బలమైనవి. అందువల్ల వాయు స్థితిలో కూడా HF అణువుల మధ్య హైడ్రోజన్ బంధాలుంటాయి. అందువల్ల HF ద్రవ స్థితినుంచి వాయు స్థితిలోకి మార్చడానికి అన్ని హైడ్రోజన్ బంధాలను ఛేదించనక్కరలేదు. ఈ కారణంగా HF బాష్పీభవన స్థానం తక్కువ. HF బాష్పీభవన స్థానం 19.4°C. నీరు బాష్పీభవన స్థానం 100°C.
ప్రశ్న 10.
ఒక పరమాణువు చుట్టూ నాలుగు బంధజంటల ఎలక్ట్రాన్లు ఉంటే వాటి మధ్య కనిష్ఠ వికర్షణలు ఉండేటట్లు ఎట్లా అమర్చాలి?
జవాబు:
నాలుగు బంధ ఎలక్ట్రాన్ జంటలు చతుర్ముఖి యొక్క నాలుగు శీర్షాలయందు అమరి ఉంటే వికర్షణలు అతి తక్కువగా ఉంటాయి. ఎలక్ట్రాన్ జంటలు గరిష్ఠ దూరంలో ఉండి వాటి మధ్య కోణం 109°28′ ఉంటుంది.
ప్రశ్న 11.
A, B లు రెండు వేర్వేరు పరమాణువులైతే అవి AB అణువును ఇస్తే ఆ అణువులో సమయోజనీయ బంధం ఎప్పుడు ఏర్పడుతుంది.
జవాబు:
AB పరమాణువుల ఋణ విద్యుదాత్మకతలలో తేడా తక్కువగా ఉన్నపుడు లేదా దాదాపు సమానంగా ఉన్నపుడు వాటి మధ్య సమయోజనీయ బంధం ఏర్పడుతుంది. ఋణ విద్యుదాత్మకతలలో తేడా 1.7 కన్నా తక్కువ ఉంటే సమయోజనీయ బంధం ఏర్పడుతుంది.
ప్రశ్న 12.
స్థానీకృత ఆర్బిటాళ్ళు అంటే ఏమిటి ?
జవాబు:
రెండు పరమాణువుల మధ్య సమయోజనీయ బంధం ఏర్పడినపుడు ఎలక్ట్రాన్ జంట మేఘ విస్తరణ రెండు పరమాణువుల మధ్య సాంద్రీకృతమై ఉంటుంది. దీనినే స్థానీకృత ఆర్బిటాలు అంటారు.
ఉదా : మీథేన్ అణువులో °C – H బంధం స్థానీకృత ఆర్బిటాల్. ఆ బంధంలోని ఎలక్ట్రాన్లను స్థానీకృత ఎలక్ట్రానులు అంటారు.
ప్రశ్న 13.
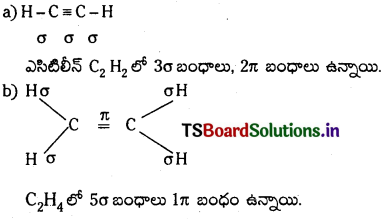
(a) C2H2;
(b) C2H4 ఈ రెండు అణువుల్లో వరుసగా దేనిలో ఎన్ని సిగ్మా పై బంధాలున్నాయో తెల్పండి.
జవాబు:
![]()
ప్రశ్న 14.
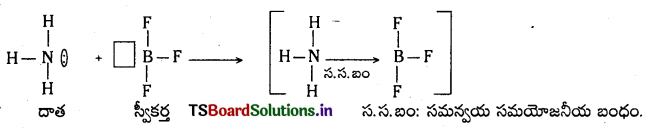
BF3 + NH3 → F3BNH3 ఈ చర్యలో బోరాన్, నైట్రోజన్ పరమాణువుల సంకరకరణంలో మార్పు ఉంటుందా ? ఉంటే ఏమిటి ?
జవాబు:
![]()
బోరాన్ [Z = 5 = 1s22s22p1] ట్రైఫ్లోరైడ్ అణువు ఏర్పడేటప్పుడు కేంద్రక ‘B’ పరమాణువు దాని ఒకటవ ఉత్తేజిత స్థితి (1s2 2s1 \(2 \mathrm{p}_{\mathrm{x}}^1 2 \mathrm{p}_{\mathrm{y}}^1 2 \mathrm{p}_{\mathrm{z}}^0\)) లో sp2 సంకరీకరణం పొందుతుంది. అపుడు దానిపై మూడు sp2 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటన్నింటిలో బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. ఆ మూడు బంధ ఎలక్ట్రాన్ జంటలు గల sp2 సంకర ఆర్బిటాళ్ళు మూడు F పరమాణువుల (1s22s22p5) 2pz ఆర్బిటాళ్లతో అభిముఖ ఆవరింపు చేసికొని మూడు సిగ్మా బంధాలను ఇస్తాయి. అంతేకాకుండా BF3 లో కేంద్రక బోరాన్ పరమాణువు మీద ఖాళీ ‘pz‘ ఆర్బిటాల్ కూడా ఉంటుంది.
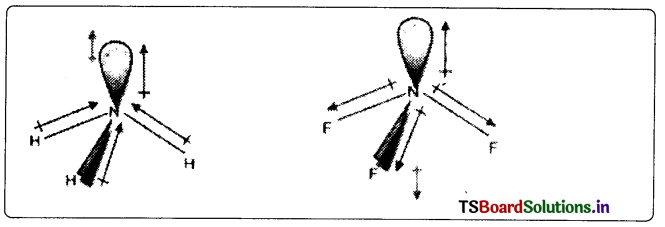
అమ్మోనియా అణువు ఏర్పడేటపుడు కేంద్రక ‘N’ పరమాణువు (1s2 2s2 2p3) దాని భూస్థితిలో sp3 సంకరీకరణం పొందుతుంది. అపుడు దానిపై నాలుగు sp3 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటిలో మూడు సంకర ఆర్బిటాళ్ళలో, బంధ జంటలు, నాల్గవ దానిలో ఒంటరి జంట ఉంటాయి. బంధ జంటలు గల మూడు సంకర ఆర్బిటాళ్ళు మూడు H పరమాణువుల 1s3 ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసికొని మూడు సిగ్మా బంధాలను ఇస్తాయి. sp3 సంకరీకరణం వల్ల NH3 అణువుకు టెట్రాహెడ్రల్ ఆకృతి ఏర్పడుతుంది.
అమ్మోనియా, బోరాన్ ట్రైఫ్లోరైడ్తో చర్య జరిపేటపుడు తన ఒంటరి జంట ఎలక్ట్రాన్లను BF3 లో ఉన్న ఖాళీ ‘p’ ఆర్బిటాల్క అందచేస్తుంది. అపుడు ఆ రెండింటి మధ్య సమన్వయ సమయోజనీయ బంధం ఏర్పడుతుంది. ఈ ప్రక్రియలో బోరాన్ తన sp2 సంకరీకరణాన్ని sp3 సంకరీకరణంగా మార్చుకుంటుంది. అందువల్ల NH3, BF3 అణువులు రెండూ అణువులో టెట్రాహెడ్రల్ ఆకృతిని కలిగి ఉంటాయి. ఇట్లేర్పడ్డ [NH3 → BF3] అణువులో N, B ల కోవేలన్సీ విలువ 4 ఉంటుంది.
లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 15.
రసాయన బంధాన్ని కొస్సెల్, లూయీలు ఎట్లా వివరించారు ?
జవాబు:
కోసెల్, లూయీలు రసాయనిక బంధాలు ఎలక్ట్రానిక్ సిద్ధాంతం ప్రతిపాదించారు. దీని ప్రకారం పరమాణువులు ఎలక్ట్రానులను కోల్పోవడం, స్వీకరించడం లేదా పంచుకోవడం ద్వారా వాటి వేలన్స్ కర్పరంలో ఎనిమిది ఎలక్ట్రానులు పొందడానికి ప్రయత్నిస్తాయి. దీనినే అష్టక నియమం అంటారు.
లూయీ, పరమాణువును ధన విద్యుదావేశం గల కెర్నెల్ గాను, బాహ్య కర్పరంగాను రెండు భాగాలుగా భావించాడు. కెర్నెల్ అంటే బాహ్య కర్పరం కాక మిగిలిన భాగం, అంటే కేంద్రకం, లోపలి కర్పరాల్లోని ఎలక్ట్రాన్లు కలిసి కెర్నెల్ అవుతుంది. వేలన్స్ కర్పరంలో అత్యధికంగా ఎనిమిది ఎలక్ట్రాన్లతో మాత్రమే ఉంటుంది. ఉత్కృష్ట వాయు పరమాణువులోని ఎలక్ట్రానులు ఘనం ఎనిమిది మూలలను ఆక్రమించి ఉంటాయి. ఈ ఎనిమిది ఎలక్ట్రానుల అమరిక ఒక స్థిరమైన ప్రత్యేక అమరిక. మూలక పరమాణువులు అష్టకం రావడం కోసమే రసాయన బంధంలో పాల్గొంటాయి.
అణువు ఏర్పడటానికి సాధారణంగా పరమాణువుల్లోని బాహ్య కర్పరాల్లోని ఎలక్ట్రానులు రసాయన సంకలన చర్యల్లో పాల్గొంటాయి. వీటిని వేలన్స్ ఎలక్ట్రానులు అంటారు.
కొస్సెల్ ప్రతిపాదనలు : 1. హాలోజన్లు ఋణ అయానులను ఏర్పరచడానికి వాటి పరమాణువులు ఎలక్ట్రానులు స్వీకరించగా, క్షార లోహాలు వాటి పరమాణువులు ధన అయానులుగా మారడానికి ఎలక్ట్రానులను కోల్పోతాయి. ధన, ఋణ అయానులు ఏర్పడినపుడు అవి స్థిరమైన ఉత్కృష్టవాయు పరమాణువుల ఎలక్ట్రాన్ విన్యాసాల్ని పొందుతాయి.
ధన, ఋణ అయానులు స్థిర విద్యుత్ బలాల చేత ఆకర్షితమై అయానిక స్ఫటికాల నేర్పరుస్తాయి.
ఈ విధంగా ఎలక్ట్రానులను పంచుకోవడం ద్వారా సమయోజనీయ బంధం, ఎలక్ట్రాన్ బదిలీ ద్వారా అయానిక బంధం ఏర్పడతాయి.
![]()
ప్రశ్న 16.
అయానిక సంయోగ పదార్థాల సాధారణ ధర్మాలు వ్రాయండి.
జవాబు:
- అయానిక పదార్థాలు ఘన స్థితిలో చాలా గట్టిగా అధిక బాష్పీభవన స్థానం, ద్రవీభవన స్థానాలతో ఉంటాయి.
- అయానిక పదార్థాలు ధ్రువ ద్రావణులైన నీటి వంటి ద్రావణులలో అధికంగా కరుగుతాయి.
- జల ద్రావణాల్లోను, గలన స్థితిలోను, ఇవి విద్యుత్, ఉష్ణవాహకాలు.
- అయానిక సంయోగ పదార్థాలు దిశలేని బంధాల నేర్పరచి ఐసోమెరిజం చూపవు.
- అయానిక పదార్థాల మధ్య చర్యలు వేగంగా జరుగుతాయి.
ప్రశ్న 17.
ఫాజన్స్ నియమాలు వ్రాసి, సరియైన ఉదాహరణలు ఇవ్వండి.
జవాబు:
సమయోజనీయ బంధాలకు పాక్షిక అయానిక బంధ లక్షణం ఉన్నట్లే, అయానిక బంధాలకు కూడా పాక్షిక సమయోజనీయ బంధ లక్షణాలుంటాయి. అయానిక బంధాల పాక్షిక సమయోజనీయ బంధ లక్షణాలను అర్థం చేసుకోవడానికి ఫాజన్స్ నియమాలను ప్రతిపాదించెను.
- ఏనయాన్ పరిమాణం పెరిగిన కొలదీ ఆ సంయోగ పదార్థం సమయోజనీయ బంధ లక్షణం పెరుగుతుంది. ఉదా : KF, KI అయానిక పదార్థాల్లో కేటయాన్ K+ స్థిరం. F– కంటే I– పెద్దది. అందుచేత KI కి KF కంటె సమయోజనీయ బంధలక్షణాలు ఎక్కువ.
- కేటయాన్ పరిమాణం తగ్గిన కొద్దీ సమయోజ బంధ లక్షణం పెరుగుతుంది.
ఉదా : LiF కు KF కంటే సమయోజనీయ బంధ లక్షణాలు ఎక్కువ. - కేటయాన్ల, ఏనయాన్ల విద్యుదావేశ పరిమాణాలు పెరిగిన కొలదీ వాటి మధ్య ఏర్పడే బంధాల సమయోజనీయ లక్షణం పెరుగుతుంది.
ఉదా : Sn+2 Cl2 కంటే Sn+4Cl4 కు సమయోజనీయ బంధ లక్షణాలు ఎక్కువ. - ఒకే విద్యుదావేశం, ఒకే పరిమాణం ఉన్న రెండు కేటయాన్లలో మిధ్యా ఉత్కృష్ట వాయు ఎలక్ట్రాన్ విన్యాసం ఉన్న కేటయాన్ ఉత్కృష్ట వాయు ఎలక్ట్రాన్ విన్యాసం ఉన్న కేటయాన్ల కంటె ధ్రువణ సామర్థ్యం ఎక్కువ. ఉదా : NaCl కంటే CuCl ఎక్కువ సమయోజనీయ బంధ లక్షణాలతో ఉంటుంది.
కారణం · Cu+, Cl– ను Na+ కంటే ఎక్కువ ధ్రువణం చెందిస్తుంది.
![]()
ప్రశ్న 18.
అష్టక నియమం అంటే ఏమిటి ? దీనిని సంక్షిప్తంగా వివరించి దాని లోపాలు తెలపండి.
జవాబు:
పరమాణువులు ఎలక్ట్రానులను కోల్పోవడం, స్వీకరించడం లేదా పంచుకోవడం ద్వారా వేలన్స్ కర్పరంలో ఎనిమిది ఎలక్ట్రాన్లు పొందడానికి ప్రయత్నిస్తాయి. దీనినే నియమం అంటారు.
“స్థిరత్వం పొందటానికై ప్రతి పరమాణువు తన బాహ్య కర్పరంలో 8 ఎలక్ట్రాన్లను కలిగి ఉండాలి” అనే నియమాన్ని అష్టక నియమం అనవచ్చు. బాహ్య కర్పరంలో 8 ఎలక్ట్రాన్లు కలిగి ఉన్న పరమాణువులు రసాయనికంగా స్థిరత్వం కలిగి ఉంటాయి. అందువల్ల అవి రసాయన చర్యలలో పాల్గొనవు. బాహ్య కర్పరంలో 8 కన్నా తక్కువ ఎలక్ట్రాన్లు గల పరమాణువులు స్థిరత్వం పొందడానికై అంటే ఎలక్ట్రాన్ అష్టకాన్ని పొందడానికై ఇతర పరమాణువులతో కలుస్తాయి.
పరమాణువులు తమ బాహ్య కర్పరంలో అష్టకాన్ని పొందడానికై రెండు విధాలుగా కలుస్తాయి. ఒక పద్దతిలో ఒక పరమాణువు నుండి వేరొక పరమాణువుకు ఎలక్ట్రాన్లు బదిలీ అయి వెళ్ళిపోవడం. రెండవ పద్ధతిలో సంయోగం చెందే రెండు పరమాణువులు ఎలక్ట్రాన్లను సమానంగా సమిష్టిగా పంచుకోవడం.
సార్ధకత : బాహ్య కర్పరంలో అష్టక విన్యాసం కలిగిఉన్న అణువులు అధిక స్థిరత్వం కలిగి ఉంటాయి.
ఉదా : NH3, H2O అణువులు. ఈ అణువులలో కేంద్రక ‘N’ పరమాణువు మరియు కేంద్రక ‘0’ పరమాణువులు ఎలక్ట్రాన్ అష్టకాన్ని కలిగి ఉంటాయి. అందువల్ల అవి అధిక స్థిరత్వం కలిగి ఉంటాయి.
పరమాణువులే కాకుండా అష్టక విన్యాసం కలిగి ఉన్న అయాన్లు కూడా స్థిరంగా ఉంటాయి. ఆ కారణంగా పరమాణువుల నుండి కొన్ని అయాన్లు మాత్రమే పొందగలం. కొన్నింటిని పొందలేం. ఉదా : Na పరమాణువు నుండి Na+ సులువుగా పొందవచ్చును. Na+2 ను పొందజాలము. ఎందుకనగా Na+ కు స్థిర ‘Ne’ విన్యాసం ఉంటుంది. దీని నుండి మరొక ఎలక్ట్రానన్ను తీసివేసి Na+2 ను పొందడం చాలా కష్టం.
లోపాలు :
- కొన్ని సంయోగ పదార్థాలలో కేంద్ర పరమాణువు చుట్టూ ఎనిమిది కంటే తక్కువ ఎలక్ట్రానులు ఉంటున్నాయి.
ఉదా : BCl3, LiCl, BeH2 - కొన్ని సందర్భాలలో అష్టక విస్తృతి జరిగి కేంద్ర పరమాణువు చుట్టూ 8 కంటే ఎక్కువ ఎలక్ట్రానులు పరివేష్టించి ఉండవచ్చు. ఉదా : PF5, SF6
- అష్టక నియమం ఉత్కృష్ట వాయువుల జడస్వభావం ఆధారంగా ప్రతిపాదించబడింది. అయితే కొన్ని ఉత్కృష్ట వాయువులు Kr, Xe ఆక్సిజన్, ఫ్లోరీన్లతో కలిసి అనేక సమ్మేళనాలనిస్తున్నాయి.
ఉదా : XeF2, XeF4, KrF2, XeO2, XeO3, XeO4. - అణువుల ఆకృతిని అష్టక సిద్ధాంతం వివరించదు.
- ఈ సిద్ధాంతం అణువుల సాపేక్ష స్థిరత్వాలను కాని అణువు శక్తిని గాని వివరించదు.
ప్రశ్న 19.
NO2, N\(\mathbf{O}_3^{-}\) ల రెజోనెన్సు నిర్మాణాలు రాయండి.
జవాబు:
NO2 రెజోనెన్సు రూపాలు :
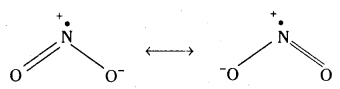
N\(\mathrm{O}_3^{-}\) రెజోనెన్సు నిర్మాణాలు :
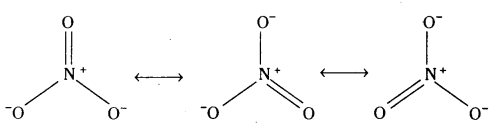
ప్రశ్న 20.
కింది పరమాణు జంటల్లో అవి కాటియాన్లు, ఏనయాన్లు ఏర్పరచేటప్పుడు జరిపే ఎలక్ట్రానుల మార్పులను లూయీ చుక్కల పద్ధతిలో ఇవ్వండి.
(a) K, S
(b) Ca, O
(c) Al, N.
జవాబు:
(a) 19K ఎలక్ట్రాన్ విన్యాసం = 1s2 2s2 2p6 3s2 3p6 4s1
16S ఎలక్ట్రాన్ విన్యాసం = 1s2 2s2 2p6 3s2 3p4
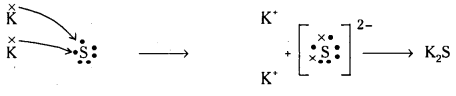
b) 20Ca ఎలక్ట్రాన్ విన్యాసం = 1s2 2s2 2p6 3s2 3p6 4s2
8O ఎలక్ట్రాన్ విన్యాసం = 1s2 2s2 2p4
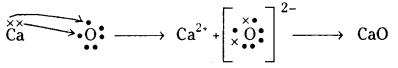
c) 13Al = 1s2 2s2 2p6 3s2 3p1
7N = 1s2 2s2 2p3
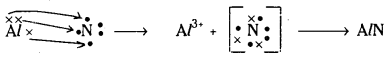
ప్రశ్న 21.
H2O కు ద్విధ్రువ భ్రామకం ఉంది. కాని CO2 కు లేదు ఎందువల్ల ?
జవాబు:
బహుపరమాణుక అణువుల్లో అణువుల ద్విధ్రువ భ్రామకాలు అణువుల్లోని ప్రతిబంధం ద్విధ్రువభ్రామకం విలువల మీదనే కాక కేంద్రక పరమాణువు చుట్టూ ఆ బంధాలు ప్రాదేశికంగా ఎలా అమర్చబడ్డాయి అన్న అంశంపై కూడా ఆధారపడి ఉంటాయి. అలాంటప్పుడు అణువు ద్విధ్రువ భ్రామకం అందులోని బంధాల బంధ భ్రామకాల సదిశ మొత్తం విలువ అవుతుంది.
నీటి అణువుకు కోణీయ నిర్మాణం ఉంటుంది. H2O లో బంధకోణం 104.5° నీటి అణువు ఫలిత ద్విధ్రువ భ్రామకం
µ = 1.85-డిబై.
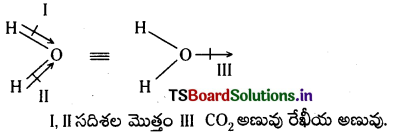
CO2 అణువు ద్విధ్రువ భ్రామకం సున్న. దీనికి కారణం రెండు C = O బంధాలు 180° కోణంలో ఒకదానికి ఇంకొకటి.వ్యతిరేక దిశలో సమాన బంధ భ్రామకాలతో ఉండి రెండు C = 0 బంధాల బంధ ద్విధ్రువ విలువల మొత్తం సున్నా అవుతుంది.
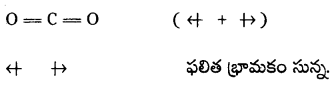
![]()
ప్రశ్న 22.
ద్విధ్రువ భ్రామకాన్ని నిర్వచించండి. దీని అనువర్తనాలేమిటి?
జవాబు:
రెండు వేర్వేరు మూలకాల పరమాణువుల మధ్య సమయోజనీయబంధం ఏర్పడినపుడు బంధ ఎలక్ట్రాన్ జంట అధిక ఋణ విద్యుదాత్మక పరమాణువుకు దగ్గరగా ఉంటుంది. అందువల్ల అధిక ఋణ విద్యుదాత్మక పరమాణువుకు పాక్షిక రుణావేశం, అల్ప ఋణ విద్యుదాత్మక పరమాణువుకు పాక్షిక ధనావేశం కలుగుతాయి. ఇటువంటి అణువును ధృవాణువు అంటారు.
ద్విధ్రువ భ్రామకం : ఒక ద్విపరమాణుక ధ్రువ అణువు ద్విధ్రువ భ్రామకం ఆ అణువులోని ఒకదాని మీది విద్యుదావేశ పరిమాణం, ధన, ఋణ ఆవేశాల మధ్య దూరం లబ్ధంగా నిర్వచించవచ్చు.
ద్విధ్రువ భ్రామకం µ = విద్యుదావేశం (δ) × విద్యుదావేశాల మధ్య దూరం.
µ = δ × l
ద్విధ్రువభ్రామకాన్ని డిబై ప్రమాణాలలో తెలుపుతారు.
1 D = 3.33564 × 10-30c.m.
C = కులూంబ్; m = మీటర్
అనువర్తనాలు :
- సమయోజనీయ బంధ అయానిక స్వభావ శాతాన్ని లెక్కించవచ్చు.
అయానిక స్వభావ శాతం = \(\frac{\mu_{\text {obs }}}{\mu_{\text {ionic }}}\) × 100 - అణువుల ఆకృతులను ఊహించవచ్చు.
- AX2 రకం అణువులు రేఖీయ నిర్మాణాన్ని కల్గిఉంటే µ = 0
రేఖీయ నిర్మాణాన్ని కలిగి ఉంటే µ కు కొంత విలువ ఉంటుంది.
CO2 అణువు µ = 0
H2O అణువు µ = 1.85 D - AX3 రకపు అణువులు సమతల త్రిభుజాకారంలో ఉంటే µ = 0. పిరమిడల్ ఆకృతి కలిగి ఉంటే కొంత µ విలువను కలిగి ఉంటాయి.
BF3, µ = 1.47 - AX4 రకపు అణువు చతుర్ముఖీయంగా ఉంటే µ = 0; విరూపణ చెందితే µ > 0.
- AX2 రకం అణువులు రేఖీయ నిర్మాణాన్ని కల్గిఉంటే µ = 0
ప్రశ్న 23.
BeF2, బంధాలకు ధృవత్వమున్నా BeF2 అణువుకు ద్విధ్రువ భ్రామకం సున్నా. వివరించండి.
జవాబు:
ఒక అణువు ద్విధ్రువ భ్రామకం అందులోని బంధాల బంధభ్రామకాల సదిశ మొత్తం విలువ అవుతుంది. Be-F బంధం ధ్రువశీలత గలది. BeF2 రేఖీయ నిర్మాణం గలది. రెండు Be-F బంధాలు 180° కోణంలో ఒకదానికి ఇంకొకటి వ్యతిరేక దిశలో ఉంటాయి. బంధ భ్రామకం సదిశరాశి కావటం వల్ల వ్యతిరేక దిశలలో ఉన్న సదిశల మొత్తం సున్న. అందువల్ల రెండు Be-F బంధాల బంధ భ్రామకాల మొత్తం విలువ సున్న.

BeF2 లో బంధ భ్రామకాలు.
ప్రశ్న 24.
CH4 అణువు నిర్మాణాన్ని వివరించండి.
జవాబు:
CH4 అణువును ఏర్పరచే కార్బన్ పరమాణువు భూస్థితి ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p2 ఉద్రిక్తస్థితిలో ఒక 2s ఎలక్ట్రాన్ ఖాళీ 2p ఆర్బిటాల్క మారుతుంది. ఉద్రిక్త స్థితి విన్యాసం కార్బన్ పరమాణువుకు 1s2 2s1 2p3. ఒక్కొక్క ఎలక్ట్రాన్ మాత్రమే ఉన్న వేలన్స్ కర్పరంలలోని 2s ఆర్బిటాల్, మూడు 2p ఆర్బిటాళ్ళు సంకరకరణం చెంది నాలుగు సర్వ సమానమైన sp3 ఆర్బిటాళ్ళనిస్తాయి.
ఒక్కొక్క sp3 ఆర్బిటాల్కు 25% s లక్షణం 75% p లక్షణం ఉంటుంది. నాలుగు సంకర sp3 ఆర్బిటాళ్ళు ఒకదానికొకటి దూరంగా త్రిమితీయ ప్రదేశంలో దిగ్విన్యాసం చెందుతాయి. కేంద్ర పరమాణువు కార్బన్ కనుక చతుర్ముఖి కేంద్రంలో ఉందనుకుంటే నాలుగు సంకర sp3 ఆర్బిటాళ్ళు చతుర్ముఖి నాలుగుమూలలకు దిగ్విన్యాసం చెందుతాయనుకోవచ్చు.’ ఈ నాలుగు సంకర sp3 ఆర్బిటాళ్ళు నాలుగు హైడ్రోజన్ పరమాణువుల 1s ఆర్బిటాళ్ళతో అతిపాతం చెందిస్తాయి. sp3 ఆర్బిటాళ్ళ మధ్యకోణం 109.5° అంటే CH4 అణువులో HCH = 109.5° అణువు ఆకృతి చతుర్ముఖీయం.
ప్రశ్న 25.
ధ్రువ సమయోజనీయ బంధాన్ని సరియైన ఉదాహరణలతో వివరించండి.
జవాబు:
రెండు ఒకే మూలకపు పరమాణువుల మధ్య సమయోజనీయబంధం ఏర్పడితే, పంచుకోబడిన ఎలక్ట్రాన్ జంట రెండు కేంద్రకాలకు మధ్య సమానంగా పంచుకోబడుతుంది. రెండు కేంద్రకాలకు సమాన దూరంలో ఉంటుంది. ఈ విధంగా ఏర్పడిన బంధాన్ని అధ్రువ సమయోజనీయ బంధం అంటారు.
వేర్వేరు మూలకాల రెండు పరమాణువుల మధ్య బంధం వల్ల ఏర్పడే HF లాంటి విజాతీయ కేంద్రకాల అణువులో పంచుకోబడ్డ ఎలక్ట్రాన్ జంట రెండు కేంద్రకాలకు సమాన దూరంలో ఉండదు. ఎక్కువ రుణ విద్యుదాత్మకత ఉన్న ఫ్లోరీన్ ‘వైపు ఎక్కువగా జరుగుతుంది. అంటే హైడ్రోజన్ పరమాణు కేంద్రానికి దూరంలో స్థానభ్రంశం చెందుతాయి. దీని ఫలితంగా ఆ రెండు (H, F) పరమాణువుల మధ్య ఏర్పడిన బంధం ధ్రువ సమయోజనీయ బంధం.
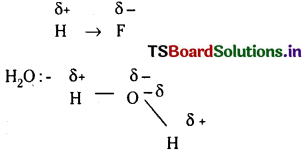
ప్రశ్న 26.
BCl3 అణువులోని బంధకోణం, అణువు నిర్మాణాలను వేలన్స్ బంధ సిద్ధాంతం ఉపయోగించి వివరించండి.
జవాబు:
- ఈ సంకరణంలో ఒక s ఆర్బిటాల్, రెండు p- ఆర్బిటాళ్ళు పాల్గొని మూడు సమానమైన sp2 సంకర ఆర్బిటాళ్ళనిస్తాయి. ఉదాహరణకు BCl3 ని తీసికొన్నచో అణువులోని కేంద్ర ‘B’ పరమాణువుకు భూస్థితిలోని ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p1 ఉద్రిక్తస్థితిలో ఒక 25 ఎలక్ట్రాన్ ఖాళీగా ఉన్న ఒక 2p ఆర్బిటాల్క మారుతుంది. దీని కారణంగా ‘B’ పరమాణువుకు మూడు జతకూడని ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి.
- ఒక్కొక్క ఎలక్ట్రాన్ మాత్రమే ఉన్న మూడు ఆర్బిటాళ్ళు (ఒక 2s, రెండు 2p) సంకరీకరణం చెంది మూడు sp సంకర ఆర్బిటాళ్ళనిస్తాయి.
- ఈ మూడు సంకర ఆర్బిటాళ్ళు త్రికోణీయ సమతలంలో దిగ్విన్యాసం చెంది మూడు క్లోరీన్ పరమాణువులు ఒంటరి ఎలక్ట్రాన్లున్న 3p ఆర్బిటాళ్ళతో అతిపాతం చెంది మూడు B – C1 బంధాలనిస్తాయి.
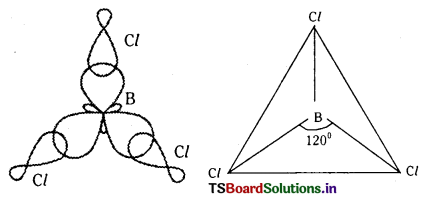
- BCl3 అణువులో బంధకోణం ∠CIBCI 120° గాను అణువు ఆకృతి త్రికోణీయ సమతలంగాను ఉంటుంది.
![]()
ప్రశ్న 27.
σ, π బంధాలంటే ఏమిటి ? వాటి మధ్య భేదాలను తెలపండి.
జవాబు:
సమయోజనీయ బంధాన్ని ఆర్బిటాళ్ళ అతిపాతం చెందే విధానాన్ని బట్టి రెండు రకాలుగా విభజించవచ్చు.
1) సిగ్మా (σ) బంధం
2) π (పై) బంధం.
1) సిగ్మా (σ) బంధం : ఈ బంధం బంధక ఆర్బిటాళ్ళు అంతర్ కేంద్రక అక్షం దిశలో అతిపాతం చెందటం వల్ల ఏర్పడుతుంది. బంధమేర్పరచే రెండు పరమాణువుల కేంద్రకాల మధ్య ఆర్బిటాళ్ళు అతిపాతం చెందడాన్ని ఎండ్ – ఎండ్ (end – end) లేదా హెడ్ఆన్ (Head on) అతిపాతం అంటారు. దీనినే ఏక్సియల్ అతిపాతం అని కూడా అంటారు. అలాంటి అతిపాతం వల్ల వచ్చిన బంధాన్ని ‘σ’ బంధం అంటారు. ఇలాంటి అతిపాతం ఆర్బిటాళ్ళ స్వభావాన్ని బట్టి అనేక రకాలుగా ఉండవచ్చు.
s – s అతిపాతం : దీనిలో ఒకే ఎలక్ట్రాన్ ఉన్న ఒక పరమాణువు s ఆర్బిటాల్. ఒకే ఎలక్ట్రాన్ ఉన్న రెండో పరమాణువు ‘s’ ఆర్బిటాల్ అంతర్ కేంద్రక అక్షం దిశలో అతిపాతం చెంది σs-s బంధం ఇస్తాయి.
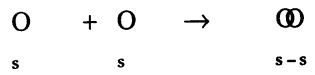
π బంధం : π బంధం ఏర్పరచే పరమాణు ఆర్బిటాళ్ళు ఒక్కొక్క ఎలక్ట్రాన్తో అంతర్ కేంద్రక అక్షానికి లంబదిశ అక్షంలో ఉంటాయి. అంటే ఈ ఆర్బిటాళ్ళ అక్ష దిశలు అంతర్ కేంద్రక అక్షానికి లంబంగా ఉంటాయి. ఈ ఆర్బిటాళ్ళు ఏటవాలుగా అతిపాతం చెందడంవల్ల ఏర్పడే విద్యుదావేశ మేఘాలు పరమాణు కేంద్రకాల తలానికి పైనా కిందా విస్తరించి ఉంటాయి.
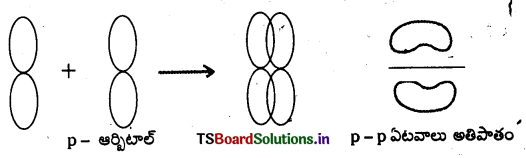
సిగ్మా, పై బంధాల మధ్య గల తేడా:
ప్రశ్న 28.
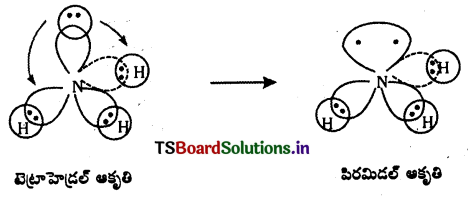
NH3 అణువులో నైట్రోజన్ పరమాణువు sp3 సంకరకరణ స్థితిలో ఉన్నా HNH బంధకోణం 109°28′ కాకుండా వేరేగా ఉంది. వివరించండి.
జవాబు:
అమ్మోనియా ఆణువు ఆకృతి : అమ్మోనియా అణువు ఏర్పడేటప్పుడు కేంద్రక నైట్రోజన్ పరమాణువు దాని ఉత్తేజిత స్థితిలో (1s22s2 \(2 p_x^1 2 p_y^1 2 p_z^1\) sp3) సంకరీకరణం పొందుతుంది. తత్ఫలితంగా దానిపై నాలుగు sp3 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటిలో మూడు సంకర ఆర్బిటాళ్ళలో బంధ జంటలు, నాల్గవ దానిలో ఒంటరి జంట ఉంటాయి. కేంద్రక పరమాణువు sp3 సంకరీకరణం పొందడం వల్ల అణువుకు టెట్రాహెడ్రల్ ఆకృతి ఏర్పడాలి. కాని ఒంటరి ఎలక్ట్రాన్ జంట ఉండటం వల్ల VSEPR సిద్ధాంతం ప్రకారం అణువు యొక్క ఆకృతిలో విరూపణ వచ్చి, అణువు పిరమిడల్ ఆకృతిని పొందుతుంది. బంధకోణం 109°28′ లకు బదులుగా 107° లకు తగ్గుతుంది.
ప్రశ్న 29.
(a) C2H4,
(b) C2 H2 లలో వరుసగా కార్బన్ పరమాణువుల మధ్య ద్విబంధం, త్రికబంధం ఎలా ఏర్పడతాయో వివరించండి.
జవాబు:
C2H4 అణువు ఏర్పడుట :
C2H4 అణువు ఏర్పడేటపుడు రెండు కార్బన్ పరమాణువులు వాటి ఉత్తేజిత స్థితిలో sp2 సంకరీకరణం పొందుతాయి. తత్ఫలితంగా వాటిపై ఆరు sp2 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటన్నింటిలో బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. మొదటిగా ఒక కార్బన్ పరమాణువులోని ఒక sp2 సంకర ఆర్బిటాల్ మరియు రెండవ కార్బన్ పరమాణువులోని ఒక sp2 సంకర అర్బిటాల్ పరస్పరం అభిముఖ ఆవరింపు చేసుకొని రెండు కార్బన్ పరమాణువుల మధ్య సిగ్మా బంధాన్ని ఏర్పరచుకుంటాయి.
మిగిలిన నాలుగు sp2 సంకర ఆర్బిటాళ్ళు నాలుగు H పరమాణువులు 1s ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకొని కార్బన్ – హైడ్రోజన్ల మధ్య నాలుగు సిగ్మా బంధాలను యిస్తాయి. ఇప్పుడు రెండు కార్బన్ల మీద సంకరీకరణంలో పాల్గొనకుండా మిగిలిపోయిన పరిశుద్ధ 2pz ఆర్బిటాళ్ళు ప్రక్కవాటుగా ఆవరింపు చేసుకుని రెండు కార్బన్ల మధ్య పై బంధాన్ని ఏర్పరుస్తాయి. ఈ విధంగా C2H4 (ఇథిలీన్) అణువులో అయిదు సిగ్మా బంధాలు ఒక పై బంధం ఉంటాయి. ఇథిలీన్ అణువు సమతల త్రిభుజాకృతిని కలిగి ఉంటుంది. బంధకోణం 120° ఉంటుంది.
C2H2 (ఎసిటిలీన్) అణువు ఏర్పడుట :
C2H2 అణువు ఏర్పడేటపుడు రెండు కార్బన్ పరమాణువులు sp సంకరీకరణము పొందుతాయి. తత్ఫలితంగా వాటిపై నాలుగు Sp సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటన్నింటిలోనూ బంధ జంటలు ఉంటాయి. మొదటిగా ఒక కార్బన్ పరమాణువులోని ఒక sp సంకర ఆర్బిటాల్, రెండవ కార్బన్ పరమాణువులోని ఒక sp సంకర ఆర్బిటాల్ అభిముఖ ఆవరింపు చేసుకొని రెండు కార్బన్ల మధ్య సిగ్మా బంధాన్ని ఏర్పరుస్తాయి.
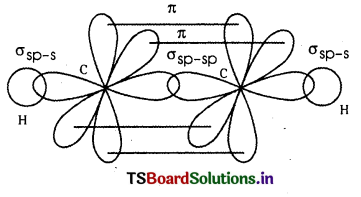
మిగిలిన రెండు sp సంకర ఆర్బిటాళ్ళు రెండు H పరమాణువులు 1s ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకొని C, Hల మధ్య సిగ్మా బంధాలను ఏర్పరచుకుంటాయి. ఇపుడు రెండు కార్బన్లలో సంకరీకరణంలో పాల్గొనకుండా మిగిలి ఉన్న 2py, 2pz పరిశుద్ధ ఆర్బిటాళ్ళు పరస్పరం ప్రక్కవాటుగా ఆవరింపు చేసుకొని వాటి మధ్య రెండు పై బంధాలను యిస్తాయి. ఈ విధంగా ఎసిటలీన్ అణువులో మూడు సిగ్మా బంధాలు రెండు పై బంధాలు ఉన్నాయి. కేంద్రక కార్బన్ పరమాణువులు sp సంకరీకరణం పొందడం వల్ల C2H2 అణువు రేఖీయంగా ఉంటుంది. బంధకోణం 180° ఉంటుంది.
![]()
ప్రశ్న 30.
PCl5 అణువు ఏర్పడటంలో p సంకరకరణం వివరించండి.
జవాబు:
ఫాస్పరస్ పరమాణు సంఖ్య = 15
భూస్థాయి విన్యాసం = 1s22s22p63s23p3
ఉత్తేజిత ఎలక్ట్రాన్ విన్యాసం = 1s22s22p6\(3 p_x^1 3 p_y^1 3 p_z^1 3 d_{x y}^1\) PCl5 అణువు ఏర్పడేటప్పుడు కేంద్రక ‘P’ పరమాణువు దాని ఉత్తేజిత స్థితిలో sp3d సంకరీకరణం పొందుతాయి. తత్ఫలితంగా దానిపై అయిదు సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటన్నింటిలో బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. ఇపుడు ఈ అయిదు సంకర ఆర్బిటాళ్ళు ఐదు క్లోరిన్ పరమాణువుల 3pz ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకుని ఐదు సిగ్మా బంధాలను యిస్తాయి. PCl5 అణువు ట్రైగొనల్ బై పిరమిడల్ ఆకృతి కలిగి ఉంటుంది. బంధకోణం 90° మరియు 120° ఉంటుంది.
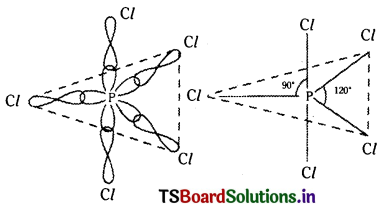
మూడు P – CI బంధాలు ఒక తలంలో ఉండి CI – P – CI బంధకోణం 120° గా ఉంటుంది. ఈ మూడు P – CI బంధాల్ని ఈక్వటోరియల్ బంధాలు అంటారు. మిగిలిన రెండు P-CI బంధాలు ఒకటి ఈక్వటోరియల్ తలానికి పైకి రెండోది కిందికి లంబంగా అంటే తలానికి 90° లో ఉంటాయి. ఈ బంధాల్ని ఏక్సియల్ (అక్షీయ) బంధాలంటారు. రెండు ఈక్విటోరియల్ బంధాల మధ్య 120° తో దూరం ఉంటే ఒక ఏక్సియల్ ఒక ఈక్వటోరియల్ బంధాల మధ్య కేవలం 90° ఉండటం వల్ల ఏక్సియల్ బంధాలు ఎక్కువ వికర్షణ నెదుర్కొంటాయి. దీనివల్ల ఇవి కొంత ఈక్వటోరియల్ బంధాల కంటె బలహీనమై సాగి ఉంటాయి. దీనివల్లనే PCl5 అణువు చాలా చురుకుగా చర్యలో పాల్గొంటుంది.
ప్రశ్న 31.
SF6 ఏర్పడటంలో సంకరకరణం వివరించండి.
జవాబు:
ఒక ‘S’ ఆర్బిటాల్, మూడు ‘p’ ఆర్బిటాళ్ళు, రెండు ‘d’ ఆర్బిటాళ్ళు కలిసిపోయి ఆరు సర్వసమానాలైన sp3d2 సంకర ఆర్బిటాళ్ళను ఏర్పరిచే ప్రక్రియను sp3d2 సంకరీకరణం అంటారు.
ఉదా : సల్ఫర్ హెక్సా ఫ్లోరైడ్ (SF6) అణువు ఏర్పడుట :
∴ సల్ఫర్ భూస్థాయి విన్యాసం = 1s22s22p63s23p4
1వ ఉత్తేజిత స్థితి విన్యాసం = 1s22s22p63s2\(3 p_x^1 3 p_y^1 3 p_z^1 3 d_{x y}^1\)
2వ ఉత్తేజిత స్థితి విన్యాసం = 1s22s22p63s1\(3 p_x^1 3 p_y^1 3 p_z^1 3 d_{x y}^1 3 d_{y z}^1\)
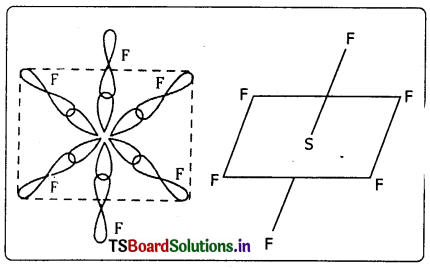
SF6 అణువు ఏర్పడేటప్పుడు కేంద్రక ‘S’ పరమాణువు sp3d2 సంకరీకరణం పొందుతుంది. తత్ఫలితంగా దానిపై ఆరు sp3d2 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటన్నింటిలో బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. ఇపుడు ఈ ఆరు సంకర ఆర్బిటాళ్ళు ఆరు F పరమాణువులు 2pz ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకుని ఆరు సిగ్మా బంధాలను యిస్తాయి.’ SF6 అణువు ఆక్టాహెడ్రల్ ఆకృతి కలిగి ఉంటుంది. బంధకోణాలు 90° మరియు 180° ఉంటాయి.
![]()
ప్రశ్న 32.
సమన్వయ సమయోజనీయ బంధం ఏర్పడే విధానాన్ని ఉదాహరణతో వివరించండి.
జవాబు:
సమన్వయ సమయోజనీయ బంధం, సమయోజనీయ బంధంలో ఒక ప్రత్యేక రకం. ఈ బంధం కూడా రెండు పరమాణువుల మధ్య ఎలక్ట్రాన్లు పంచుకోవడం వల్ల ఏర్పడుతుంది. కాని పంచుకోబడ్డ జంటను ఒక పరమాణువు రెండవ పరమాణువుకు అందజేస్తుంది. దీనిని బాణం గుర్తు (‘→”) తో సూచిస్తారు. ఈ బాణం గుర్తు దాత నుండి స్వీకర్త వైపుకు ఉండాలి. పంచుకోబడ్డ ఎలక్ట్రాన్ జంటను ఏ పరమాణువైతే అందజేస్తుందో దానిని దాత అని, పంచుకోబడ్డ ఎలక్ట్రాన్ జంటను ఏ పరమాణువైతే స్వీకరిస్తుందో దానిని స్వీకర్త అని అంటారు. రెండు పరమాణువుల మధ్య సమన్వయ సమయోజనీయ బంధం ఏర్పడాలంటే, ఒక పరమాణువుకు ఒంటరి ఎలక్ట్రాన్ జంట ఉండాలి. రెండవ పరమాణువుకు ఖాళీ ఆర్బిటాల్ ఉండాలి.
ఉదా : 1) అమ్మోనియం అయాన్. (\(\mathrm{NH}_4^{+}\)) ఏర్పడుట :
NH3 అణువు H+అయాన్ తో చర్య జరపడం వల్ల \(\mathrm{NH}_4^{+}\) అయాన్ ఏర్పడుతుంది. NH3 అణువులోని కేంద్రక N- పరమాణువు ఒంటరి ఎలక్ట్రాన్ జంటను కలిగి ఉంటుంది. H+ అయాన్కు ఖాళీ ఆర్బిటాల్ ఉంటుంది. కాబట్టి NH3 లోని కేంద్రక N – పరమాణువు తన ఒంటరి ఎలక్ట్రాన్ జంటను H+ అయాను దానం చేస్తుంది. అపుడు వాటి మధ్య సమన్వయ సమయోజనీయ బంధం ఏర్పడుతుంది.
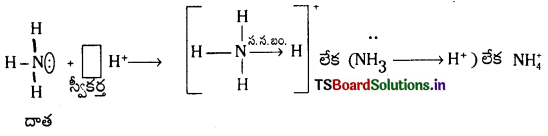
2) హైడ్రోనియం అయాన్ ఏర్పడుట (\(\mathrm{H}_3 \mathrm{O}^{+}\)) :
H2O అణువు H+అయాన్ తో చర్య జరపడం వల్ల H3O+ అయాన్ ఏర్పడుతుంది. H2O అణువులో కేంద్రక ‘O’- ఆక్సిజన్ పరమాణువుపై రెండు ఒంటరి ఎలక్ట్రాన్ జంటలు ఉంటాయి. H+ అయాన్కు ఖాళీ ఆర్బిటాల్ ఉంటుంది. కాబట్టి H2O లోని కేంద్రక ‘O’- పరమాణువు ఒక ఒంటరి ఎలక్ట్రాన్ జంటను H+ అయాను దానం చేస్తుంది. అపుడు వాటి మధ్య సమన్వయ సమయోజనీయ బంధం ఏర్పడుతుంది.
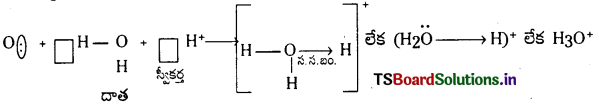
సమన్వయ సమయోజనీయ సమ్మేళనాల ధర్మాలు :
- ఈ సమ్మేళనాలు విద్యుద్వాహకాలు కాదు. ఎందులకనగా ఇవి నీటిలో అయనీకరణం చెందవు.
- బెంజీన్, కార్బన్ టెట్రాక్లోరైడ్ వంటి అధృవ ద్రావణులలో కరుగుతాయి. నీరు వంటి ధృవ ద్రావణులలో పాక్షికంగా కరుగుతాయి.
- ఈ సమ్మేళనాలు అణు సాదృశ్యాన్ని ప్రదర్శిస్తాయి. ఎందులకనగా ఈ బంధం దిశను కలిగి ఉంటుంది.
- ఈ బంధానికి ధృవశీలత పాక్షికంగా ఉంటుంది. అందువలన ఈ సమ్మేళనాల బాష్పశీలత, అయానిక మరియు సమయోజనీయ సమ్మేళనాల బాష్పశీలతలకు మధ్యస్థంగా ఉంటుంది.
ప్రశ్న 33.
కింది అణువులు ఏర్పడటంలో కార్బన్ పరమాణువులు ఏ సంకర ఆర్బిటాళ్ళనుపయోగించాయి ?
(a) CH3 – CH3
(b) CH3 – CH = CH2
(c) CH3 – CH2 – OH
(d) CH3 – CHO
జవాబు:
(a)
CH3 – CH3 లోని రెండు కార్బన్ పరమాణువులు sp3 సంకరీకరణంలో ఉంటాయి.
b) CH3 – CH = CH2
![]() లో 1, 2 కార్బన్లు sp2 సంకరీకరణం మరియు C3 కార్బన్ sp3 సంకరీకరణం చెందును.
లో 1, 2 కార్బన్లు sp2 సంకరీకరణం మరియు C3 కార్బన్ sp3 సంకరీకరణం చెందును.
c) CH3 – CH2 – OH
![]() లో C1 కార్బన్ sp2 సంకరీకరణాన్ని C2 కార్బన్ sp3 సంకరీకరణం చెంది ఉన్నాయి.
లో C1 కార్బన్ sp2 సంకరీకరణాన్ని C2 కార్బన్ sp3 సంకరీకరణం చెంది ఉన్నాయి.
d) CH3 – CHO
![]() లో CHO కార్బన్ sp2 సంకరీకరణం, CH3 కార్బన్ sp3 సంకరీకరణాన్ని పొంది ఉన్నాయి.
లో CHO కార్బన్ sp2 సంకరీకరణం, CH3 కార్బన్ sp3 సంకరీకరణాన్ని పొంది ఉన్నాయి.
ప్రశ్న 34.
హైడ్రోజన్ బంధం అంటే ఏమిటి ? విభిన్న హైడ్రోజన్ బంధాలను ఉదాహరణలతో వివరించండి.
జవాబు:
నైట్రోజన్, ఫ్లోరీన్, ఆక్సిజన్ మూలకాలు అత్యధిక ఋణ విద్యుదాత్మకత గలవి. ఈ పరమాణువులు హైడ్రోజన్తో సమయోజనీయ బంధం ఏర్పరచినపుడు బంధ ఎలక్ట్రాన్ జంట ఈ పరమాణువుల వైపు ఎక్కువగా జరిగి ఉంటుంది. అందువల్ల ఈ పరమాణువుల మీద పాక్షిక ఋణావేశం హైడ్రోజన్ పరమాణువు మీద పాక్షిక ధనావేశం ఉత్పన్నమవుతుంది. ఈ ధృవ అణువు ప్రక్కన అదే పదార్థపు వేరొక అణువు ఉంటే ఒక అణువులోని పాక్షిక ధన విద్యుదావేశంగల H పరమాణువు ప్రక్క అణువులోని పాక్షిక ఋణ విద్యుదావేశం ఉన్న పరమాణువుతో బలహీనమైన స్థిరవిద్యుత్ బంధం ఏర్పరుస్తుంది. దీనినే హైడ్రోజన్ బంధం అంటారు.
ఉదా : Hδ + _ Fδ –…………..Hδ + _ Fδ –…………..Hδ + _ Fδ –
నిర్వచనం :
హైడ్రోజన్ పరమాణువు అత్యధిక ఋణ విద్యుదాత్మకత గల మూలకం లేదా మూలకాల రెండు పరమాణువుల మధ్య ఉన్నప్పుడు అది ఒక పరమాణువుతో ధ్రువ బంధాన్ని రెండో పరమాణువుతో ఒక బలహీనమైన స్థిరవిద్యుత్ బంధాన్ని ఏర్పరుస్తుంది. ఈ స్థిర విద్యుత్ బంధమే హైడ్రోజన్ బంధం.
హైడ్రోజన్ బంధాలు రెండు రకాలు : అవి
(i) అంతరణుక హైడ్రోజన్ బంధాలు
(ii) అణు అంతర హైడ్రోజన్ బంధాలు.
(i) ఒకే పదార్థ అణువుల మధ్య లేక వేరు వేరు పదార్థాల అణువుల మధ్య ఏర్పడే హైడ్రోజన్ బంధాన్ని అంతరణుక హైడ్రోజన్ బంధం అంటారు.

(ii) ఒకే అణువులోని రెండు సమూహాల్లోని రెండు అత్యధిక ఋణ విద్యుదాత్మకత గల ఒకే మూలకపు లేదా వేర్వేరు మూలకాల పరమాణువుల మధ్య హైడ్రోజన్ వారధిగా ఉండే బంధం. అణు అంతర హైడ్రోజన్ బంధాలు.
ఉదా : ఆర్థోనైట్రోఫినాల్

![]()
ప్రశ్న 35.
వేలన్స్ బంధ సిద్ధాంతంతో H2 అణువు ఏర్పడడాన్ని వివరించండి.
జవాబు:
వేలన్స్ బంధ సిద్ధాంతం లోని అంశాలు :
- సగం నిండిన పరమాణు ఆర్బిటాళ్ళు పరస్పరం ఆవరింపు చేసుకోవడం వల్ల సమయోజనీయ బందం ఏర్పడుతుంది.
- ఆవరింపులో పాల్గొనే సగం నిండిన పరమాణు ఆర్బిటాళ్ళలోని ఎలక్ట్రాన్లు వ్యతిరేక స్పిన్లు కలిగి ఉండాలి. బంధంలో పాల్గొనే పరమాణువు తన ఆర్బిటాళ్ళ ఉనికిని పోగొట్టుకోలేదు. కాని అతిపాతం చెందే ఆర్బిటాల్లలోని ఎలక్ట్రాన్ జంటలను మాత్రం రెండు పరమాణువులు పంచుకుంటాయి.
- ఆర్బిటాళ్ళ ఆవరింపు పరిమితి మీద బంధ బలం ఆధారపడి ఉంటుంది. ఆవరింపు ఎక్కువగా ఉంటే బంధ బలం ఎక్కువగా ఉంటుంది. ఆవరింపు తక్కువగా ఉంటే బంధబలం తక్కువగా ఉంటుంది.
- ఆవరింపులో పాల్గొనే పరమాణు ఆర్బిటాళ్ళు ఎక్కువగా ఏ దిశలో కేంద్రీకృతం అవుతాయో ఆ దిశ ఏర్పడ్డ బంధం యొక్క దిశను సూచిస్తుంది.
- సంయోగం చెందే రెండు పరమాణువుల ఆర్బిటాళ్ళు అతిపాతం చెందడం వల్ల అంతర్ కేంద్ర అక్షంపై ఎలక్ట్రాన్ సాంద్రత పెరుగుతుంది. దీనివల్ల రెండు పరమాణువులు ఒకదానివైపు మరొకటి ఆకర్షితం అవుతాయి. దీని ఫలితంగా అణువు స్థిరీకరణం చెందుతుంది.
- ‘s’ ఆర్బిటాల్ తప్ప మిగిలిన అన్ని పరమాణు ఆర్బిటాళ్ళు దిశను కలిగి ఉంటాయి. అందువలన అవి ఆవరింపు చేసుకోవడం వల్ల ఏర్పడే బంధానికి కూడా దిశ ఉంటుంది. ఇది అణువు యొక్క ఆకృతిని నిర్ణయిస్తుంది.
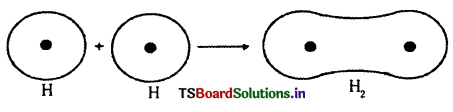
ఉదా : హైడ్రోజన్ అణువు ఏర్పడుట ( s – s ఆవరింపు) : H పరమాణు సంఖ్య 1. కాబట్టి దాని ఎలక్ట్రాన్ విన్యాసం 1s1. దీనిలో సగం నిండిన ” ఆర్బిటాల్ ఉన్నది. రెండు H పరమాణువుల 1s ఆర్బిటాళ్ళు పరస్పరం అభిముఖం ఆవరింపు చేసుకోవడం వల్ల H2 అణువు ఏర్పడుతుంది. రెండు H పరమాణువుల మధ్య ఏర్పడే ఈ బంధాన్ని సిగ్మా సమయోజనీయ బంధం అంటారు. ఇది s-s ఆవరింపుకు ఉదాహరణ.
ప్రశ్న 36.
B2 అణువు పరాయస్కాంత ధర్మం గలది ఉంది. అణు ఆర్బిటాల్ సిద్ధాంతంతో దానిని వివరించండి.
జవాబు:
బోరాన్ పరమాణువు ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p1. రెండు బోరాన్ పరమాణువులు వాటి పరమాణు ఆర్బిటాళ్ల రేఖీయ కలయికతో B2 అణువు ఏర్పడుతుంది. B2 అణువులో మొత్తం పది ఎలక్ట్రాన్లుంటాయి.
B2 అణు ఎలక్ట్రాన్ విన్యాసం (σ 1s)2 (σ* 1s)2 (σ 2s)2 (σ*2s)2 (π2p1 = x2p1)
బంధ క్రమం B2 అణువుకు \(\frac{\mathrm{N}_{\mathrm{b}}-\mathrm{N}_{\mathrm{a}}}{2}\) = \(\frac{6-4}{2}\) = 1
π అణు ఆర్బిటాల్లలో జతలేని ఎలక్ట్రానులు రెండు ఉన్నాయి. అందువల్ల B2 పరాయస్కాంత ధర్మాన్ని కలిగి ఉంది.
![]()
ప్రశ్న 37.
పరమాణు ఆర్బిటాళ్ల రేఖీయ కలయికకు నియమాలేమిటి ? వివరించండి.
జవాబు:
రెండు హైడ్రోజన్ పరమాణువుల పరమాణు ఆర్బిటాళ్ళ తరంగ ప్రమేయాలు ψA, ψB అనుకుంటే, పరమాణు ఆర్బిటాళ్లు కలిసి అణు ఆర్బిటాళ్ళను ఏర్పరుస్తాయి.
అణుఆర్బిటాల్ = ψA ± ψB
ఆర్బిటాళ్లు రేఖీయంగా కలవడానికి కావలసిన పరిస్థితులు :
- రేఖీయ కలయిక చెందే పరమాణు ఆర్బిటాళ్ల శక్తి ఒకే విలువతో కాని లేదా దాదాపు ఒకే విలువతోగాని ఉండాలి. ఒక పరమాణువు 1s ఆర్బిటాల్తో రెండో పరమాణువు 1s ఆర్బిటాల్ కలుస్తుంది. కాని ‘2s’ ఆర్బిటాల్తో కాదు. కారణం 2s ఆర్బిటాల్క 1s కంటే ఎక్కువ శక్తి ఉండటమే. ఇది ముఖ్యంగా ఒకే రకమైన కేంద్రకాల ద్విపరమాణుక అణువులకు వర్తిస్తుంది.
- అణు అక్షం పరంగా కలయికలో పాల్గొనే పరమాణు ఆర్బిటాళ్ళకు ఒకే సౌష్ఠవం ఉండాలి. ఒక పరమాణువు 2pz ఆర్బిటాల్ వేరే పరమాణువు 2pz తో కలుస్తుంది. కాని 2px లేదా 2px లతో కలవదు.
- రేఖీయ కలయిక చెందే ఆర్బిటాళ్లు గరిష్ఠంగా అతిపాతం చెందాలి.
ప్రశ్న 38.
బంధ క్రమం అంటే ఏమిటి ? క్రింది అణువుల్లో బంధ క్రమమెంత ?
(a) N2
(b) O2
(c) \(\mathrm{O}_2^{2+}\)
(d) \(\mathbf{O}_2^{-}\)
జవాబు:
బంధక్రమం’ బంధక ఆర్బిటాళ్లలోని మొత్తం ఎలక్ట్రాన్ల సంఖ్యకు (Nb) అపబంధక ఆర్బిటాళ్లలోని మొత్తం ఎలక్ట్రానులు సంఖ్య (Na) భేదం గణించి దానిని సగం చేస్తే వచ్చే విలువ.
బంధక్రమం = \(\frac{1}{2}\)[Nb – Na]
a) N2 అణు ఆర్బిటాల్ విన్యాసం :
![]()
బంధక్రమం = \(\frac{6-2}{2}\) = 2
b) O2 అణు విన్యాసం :
![]()
బంధక్రమం = \(\frac{6-2}{2}\) = 2
c) \(\mathbf{O}_2^{2+}\) అణు విన్యాసం :
![]()
బంధక్రమం = \(\frac{10-5}{2}\) = \(\frac{5}{2}\) = 2.5
d) \(\mathrm{O}_2^{-}\) అణు విన్యాసం :
![]()
బంధక్రమం = \(\frac{10-7}{2}\) = \(\frac{3}{2}\) = 1.5
![]()
ప్రశ్న 39.
BF3, NF3 అణువుల్లో NF3 కి ద్విధ్రువ భ్రామకం ఉన్నది. BF3 కి లేదు. ఎందువల్ల ?
జవాబు:
BF3 అణువు నికర ద్విధ్రువభ్రామకం సున్నా. ఇక్కడ మూడు B – F బంధాలు అణువులో ఉన్నాయి. రెండు B – F బంధాల బంధ ద్విధ్రువాల సదిశ మొత్తం మూడో B – F బంధం బంధ ద్విధ్రువానికి సమంగాను పూర్తి వ్యతిరేక దిశలో ఉంటుంది. అందుకే మొత్తం అణువు ద్విధ్రువభ్రామకం విలువ సున్నా.
BF3 అణువు సమతల త్రిభుజాకార ఆకృతిలో సౌష్ఠవంగా వుంటుంది. అందువల్లనే రెండు బంధాల బంధ ద్విధ్రువాల సదిశ మొత్తం మూడో B -F బంధం యొక్క బంధ ద్విధ్రువానికి సమంగాను, పూర్తి వ్యతిరేక దిశలోను ఉండి రద్దు కావడం వల్ల ఫలితభ్రామకం మొత్తం సున్నా అవుతుంది.
NF3 లో మూడు N – F బంధాలు బంధ భ్రామకాన్ని కలిగి ఉన్నాయి. అణువు సూచ్యాకార (Pyramid) ఆకృతిలో ఉంటుంది. నైట్రోజన్పై గల ఒంటరి జంట బంధ భ్రామకం NF బంధాల ఫలిత భ్రామకానికి వ్యతిరేక దిశలో ఉంటుంది. కాని ఒకదానికి ఒకటి రద్దు కావు. కొంత ఫలితభ్రామకం మిగిలి ఉంటుంది. అందువల్ల NF3 కు ద్విధ్రువభ్రామకం కలదు.
ప్రశ్న 40.
NH3, NF3 రెండు అణువులు సూచ్యాకృతిలో ఉంటాయి. అయినా NH3 కి NF3 కంటె ద్విధ్రువ భ్రామకం ఎక్కువ. ఎందువల్ల ?
జవాబు:
NH3, NF3, లు సూచ్యాకార అణువులే. రెండింటి లోను నైట్రోజన్ పరమాణువుపై ఒంటరి జత ఎలక్ట్రాన్లుంటాయి.
NH3 కు ద్విధ్రువభ్రామకం 4.9 × 10-30 cm
NF3 కు ద్విధ్రువభ్రామకం 0.8 × 10-30 cm
NH3 అణువుకు ఎక్కువ ద్విధ్రువభ్రామకం ఉండటానికి కారణం NH3 లోని మూడు N – H బంధాల ఫలిత ద్విధ్రువ భ్రామకం ఏ దిశలో ఉంటుందో ఒంటరి జంట ఎలక్ట్రాన్ల ఆర్బిటాల్ ద్విధ్రువం కూడా అదే దిశలో ఉంటుంది.
NF3 అణువులో ఒంటరి జంట ఎలక్ట్రాన్ ఆర్బిటాల్ ద్విధ్రువం మూడు N – F బంధాల ద్విధ్రువాల ఫలిత ద్విధ్రువభ్రామకానికి వ్యతిరేక దిశలో ఉంటుంది. అందుకే మొత్తం మీద NH3 కి NF3 కంటే ద్విధ్రువ భ్రామకం ఎక్కువ విలువలో ఉంటుంది.
NH3 లో నికర ద్విధ్రువభ్రామకం = 4.9 × 10-30 cm NF౩ లో నికర ద్విధ్రువభ్రామకం = 0.8 × 10-30 cm
ప్రశ్న 41.
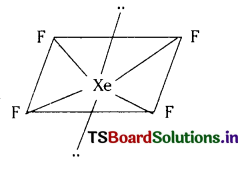
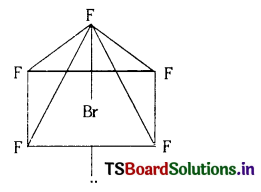
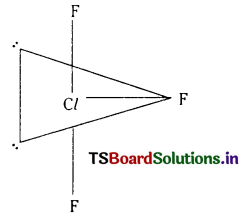
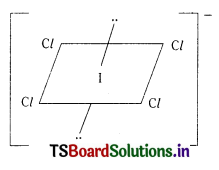
వేలన్స్ కర్పర ఎలక్ట్రాన్ జంటల వికర్షణ (VSEPR) సిద్ధాంతం ఉపయోగించి కింది అణువుల ఆకృతులను తెలపండి.
(a) XeF4
(b) BrF5
(c) CIF3
(d) IC\(l_4^{-}\)
జవాబు:
a) Xe బాహ్యకర్పరంలో 8 ఎలక్ట్రానులు ఉన్నాయి. నాలుగు Xe పరమాణువులు 4 ఫ్లోరిన్లతో నాలుగు బంధాలను ఏర్పరుస్తుంది. మిగిలిన 4 ఎలక్ట్రానులు రెండు ఒంటరి ఎలక్ట్రాన్ జంటలుగా వుంటాయి. కనుక XeF4 లో Xe పరమాణువు బాహ్య కర్పరంలో 4 బంధ ఎలక్ట్రాన్ జంటలు, 2 ఒంటరి ఎలక్ట్రాన్ జంటలు కలిసి మొత్తం 6 ఎలక్ట్రాన్ జంటలుంటాయి. ఈ ఆరు జంటలు అష్టముఖి ఆకృతిలో అమరి ఉంటాయి. వికర్షణలు కనిష్ఠంగా ఉండేటట్లు ఒంటరి జంటలు అష్టముఖి అభిముఖ శీర్షాలను ఆక్రమిస్తాయి. అందువల్ల XeF4 సమతల చతురస్రాకార ఆకృతిలో ఉంటుంది.
b) Br బాహ్యకర్పరంలో 7 + 5 = 12 ఎలక్ట్రానులు ఉంటాయి. BrF5 లో మొత్తం 5 బంధ జంటలు, ఒక ఒంటరి జంట ఉన్నాయి. మొత్తం ఆరు ఎలక్ట్రాన్ జంటలున్నాయి. ఒంటరి ఎలక్ట్రాన్ జంట ఉండుట వలన చతురస్రాకార పిరమిడ్ ఆకృతిలో ఉంటుంది.
c) ClF3 లో Cl బాహ్యకర్పరంలో 7 ఎలక్ట్రానులు, ఫ్లోరిన్ నుంచి 3 ఎలక్ట్రానులు మొత్తం 10 ఎలక్ట్రానులు ఉన్నాయి. అవి 3 బంధ జంటలు, రెండు ఒంటరి ఎలక్ట్రాన్ జంటలుగా ఉంటాయి. 5 ఎలక్ట్రాను జంటలు ట్రిగొనాల్ బై పిరమిడల్ ఆకృతిలో అమరుతాయి. రెండు ఒంటరి జంటలు ఉండుట వలన ClF3 కు ‘T’ ఆకృతి వస్తుంది.
d) \(\mathrm{lCl}_4^{-}\) లోని I బాహ్య కర్పరంలో మొత్తం ఎలక్ట్రానులు 7 + 4 + 1 = 12. వీటిలో 4 బంధ ఎలక్ట్రాన్ జంటలు. మిగిలినవి రెండు ఒంటరి జంట ఎలక్ట్రాన్లు. అవి అష్టముఖి అభిముఖ శీర్షాలను ఆక్రమిస్తాయి. \(\mathrm{lCl}_4^{-}\) కు సమతల చతురస్రాకృతి వస్తుంది.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 42.
అయానిక బంధం ఏర్పడటాన్ని సోదాహరణంగా వివరించండి.
జవాబు:
అల్ప అయొనైజేషన్ పొటెన్షియల్ విలువగల పరమాణువు నుండి అధిక ఋణ విద్యుదాత్మకత గల పరమాణువుకు ఎలక్ట్రానులు బదిలీ కావటం వల్ల ఏర్పడ్డ విరుద్ద ఆవేశాలు గల అయాన్ల మధ్య గల స్థిర విద్యుదాకర్షణ బలాలను అయానిక బంధం అంటారు.
ఉదా : సోడియం క్లోరైడ్ ఏర్పడుట.
సోడియం పరమాణువు పరమాణు సంఖ్య (Z = 11)
ఎలక్ట్రాన్ విన్యాసం 1s22s22p63s1 ఈ విన్యాసాన్ని ఆర్బిటాళ్ళ పరంగా కింది విధంగా చూపుతారు.
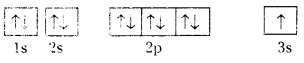
క్లోరిన్ పరమాణు సంఖ్య (Z = 17). ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p63s2 3p5. ఈ విన్యాసాన్ని ఆర్బిటాళ్ళ పరంగా కింది విధంగా చూపుతారు.
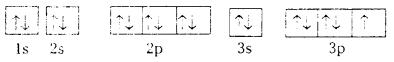
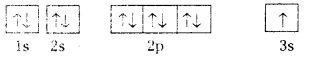
స్థిరత్వం పొందడం కోసం సోడియం పరమాణువు ఒక ఎలక్ట్రాన్ ను పోగొట్టుకొని Ne విన్యాసం పొంది Na+ ను ఇస్తుంది.
Na – e → Na+
Na+ అయాన్ ఆర్బిటాల్ విన్యాసం కింది విధంగా వుంటుంది.
అదే విధంగా స్థిరత్వం పొందడానికి Cl పరమాణువు ఒక ఎలక్ట్రాను గ్రహించుకొని Ar విన్యాసం పొంది Cl– ను ఇస్తుంది.
Cl + e → Cl–
Cl– అయాన్ ఆర్బిటాల్ విన్యాసం కింది విధంగా ఉంటుంది.
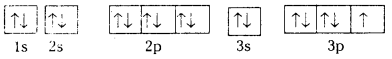
ఈ విధంగా ఏర్పడ్డ అయాన్ల మధ్య స్థిర విద్యుదాత్మక ఆకర్షణబలాలు ఏర్పడి రెండు అయాన్లను బంధిస్తాయి.

![]()
ప్రశ్న 43.
అయానిక సంయోగ పదార్థాలు ఏర్పడటానికి అనువైన పరిస్థితులు వివరించండి.
జవాబు:
a) కేటయాన్ ఏర్పడటానికి అనుకూలించే అంశాలు :
- అల్ప అయొనైజేషన్ పొటెన్షియల్ : అల్ప అయొనైజేషన్ పొటెన్షియల్ గల పరమాణువు ఎలక్ట్రాన్ను సులభంగా కోల్పోయి కేటయాన్ను ఏర్పరుస్తుంది.
K+ (IP 496 kJ mol-1) అయాన్ Na+ (IP 520 KJ mol-1) కన్నా సులభంగా ఏర్పడుతుంది. - అల్ప ఆవేశం : తక్కువ ఆవేశం గల కేటయాన్ సులభంగా ఏర్పడుతుంది. Na+, Mg++, Al+++ అయాన్లలో సులభంగా ఏర్పడే క్రమం Na+ > Mg++ > Al+++.
- అధిక పరమాణు పరిమాణం : అధిక పరమాణం గల పరమాణువులు ఎలక్ట్రాన్లను సులభంగా కోల్పోతాయి. వేలన్స్ ఎలక్ట్రాన్లపై కేంద్రక ఆకర్షణ స్వల్పంగా ఉంటుంది.
ఉదా : ఆల్కలీ లోహాలలో Cs+ అయాను సులభంగా ఏర్పడుతుంది. - జడవాయు ఎలక్ట్రాన్ విన్యాసం : జడవాయు ఎలక్ట్రాన్ విన్యాసం గల కేటయాన్ సులభంగా ఏర్పడుతుంది. ఉదా : Ca++, Zn++ అయాన్లలో Ca++ (2, 8, 8) అయాన్ Zn++ (2, 8, 18) కన్నా సులభంగా ఏర్పడుతుంది.
b) ఆనయాన్ ఏర్పడుటకు అనుకూలించే అంశాలు :
- అధిక ఋణ విద్యాదాత్మకత మరియు అధిక ఎలక్ట్రాన్ ఎఫినిటీ : అధిక EN మరియు EA గల మూలక పరమాణువులు సులభంగా ఎలక్ట్రాన్లను గ్రహించి ఆనయాన్ ను ఏర్పరుస్తాయి.
ఉదా : F– అయాను CI– కన్నా సులభంగా ఏర్పడుతుంది. - స్వల్పపరిమాణం : చిన్న పరమాణువులు గ్రహించిన ఎలక్ట్రానులను బలంగా పట్టి ఉంచగలవు. అందువల్ల
F– > Cl– > Br– > I– అయాన్లు ఏర్పడే క్రమం ఉంటుంది. - అల్ప ఆవేశం : అల్ప ఆవేశం గల అయాన్లు సులభంగా ఏర్పడతాయి.
F–, O2- కన్నా సులభంగా ఏర్పడుతుంది.
ప్రశ్న 44.
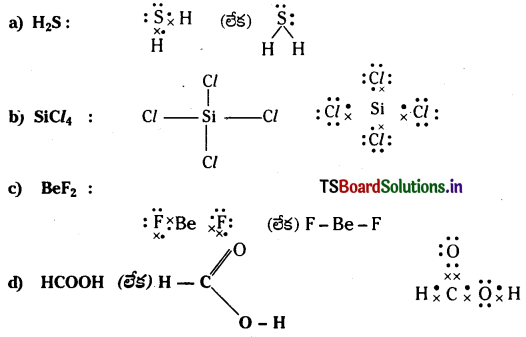
కింది అణువులకు లూయీ నిర్మాణాలు వ్రాయండి.
(a) H2S
(b) SiCl4
(c) BeF2
(d) HCOOH
జవాబు:
ప్రశ్న 45.
క్రింది వాటిని వివరించండి.
(a) బంధకోణం
(b) బంధ ఎంథాల్పీ
(c) బంధదైర్ఘ్యం
(d) బంధక్రమం.
జవాబు:
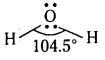
a) బంధకోణం :
ఒక అణువు లేదా సంక్లిష్ఠ అయాన్లోని కేంద్ర పరమాణువుపై ఉన్న రెండు బంధక ఆర్బిటాళ్ళ మధ్య కోణాన్ని బంధకోణం అని నిర్వచించవచ్చు. దీనిని వర్ణపట లేఖినినుపయోగించి తెలుసుకొంటారు. అణువు లేదా అణువు ఆకృతి తెలుస్తుంది.
ఉదా :
b) బంధ ఎంథాల్పీ :
ఒక మోల్ అణువుల్లోని పరమాణువుల మధ్య ఉన్న ఒక మోల్ బంధాలను విచ్ఛిత్తి చేయడానికి కావలసిన శక్తిగా బంధ ఎంథాల్పీని నిర్వచించవచ్చు. దీనిని kJ mol-1 ప్రమాణాలలో చెబుతారు.
ఉదా : H-H బంధ ఎంథాల్పీ హైడ్రోజన్లో 435.8 kJ mol-1
c) బంధ దూరం :
బంధ దైర్ఘ్యాన్ని అణువులో బంధాలు ఏర్పరచుకొన్న రెండు పరమాణువుల కేంద్రకాల మధ్య సమతాస్థితి దూరంగా నిర్వచించవచ్చు.
బంధ దైర్ఘ్యాల్ని వర్ణపట దర్శినితో గాని, X- కిరణ వివర్తన పద్ధతిలో గాని, ఎలక్ట్రాన్ – వివర్తన పద్ధతిలో కాని కొలిచి నిర్ణయిస్తారు.
రెండు ఒకే మూలకపు పరమాణువుల మధ్య సమయోజనీయ బంధం ఏర్పడితే అపుడు ఆ రెండు పరమాణు కేంద్రకాల మధ్య దూరంలో సగాన్ని పరమాణువు సమయోజనీయ వ్యాసార్ధం అంటారు.
సమయోజనీయ వ్యాసార్ధం = \(\frac{\mathrm{d}_{\mathrm{A}-\mathrm{A}}}{2}\)
dA – A ను బంధ దైర్ఘ్యమని అంటారు. ఋణ విద్యుదాత్మక భేదం ఎక్కువగా ఉన్న AB లాంటి అణువులలో భిన్న కేంద్రకాల మధ్య దూరం
dAB = rA + rB + C (XA – XB)
XA, Xb లు A, B ల ఋణ విద్యుదాత్మకతలు. C విలువ A, B పరమాణువులపై ఆధారపడి ఉంటుంది. రెండు పీరియడ్ మూలకాల పరమాణువులు బంధంలో పాల్గొంటే C విలువ 0.08
d) బంధ క్రమాంకం :
లూయీ వివరణ ప్రకారం ఒక ద్విపరమాణుక అణువు బంధ క్రమాంకం ఆ అణువులోని రెండు పరమాణువుల మధ్య ఉన్న సమయోజనీయ బంధాలకు సమానం. H2 లో H – H బంధానికి బంధక్రమాంకం ఒకటి. O2 లో O = O అణువులో రెండు ఎలక్ట్రాన్ జంటలు రెండు పరమాణువుల మధ్య పంచుకోవటం వల్ల రెండు సమయోజనీయ బంధాలు ఏర్పడతాయి. బంధక్రమాంకం రెండు అణుఆర్బిటాల్ సిద్ధాంతం ప్రకారం బంధక్రమాంకం = \(\frac{1}{2}\) (బంధక ఆర్బిటాల్లలోని ఎలక్ట్రానుల మొత్తం – అపబంధక ఆర్బిటాల్లని ఎలక్ట్రానుల మొత్తం)
B. O = \(\frac{1}{2}\) (Nb – Na)
బంధక్రమాంకం పెరిగిన కొద్దీ బంధ ఎంథాల్పీ పెరుగుతుంది. బంధ దైర్ఘ్యం తగ్గుతుంది. స్థిరత్వం పెరుగుతుంది.
ప్రశ్న 46.
వేలన్స్ కర్పర ఎలక్ట్రాన్ జంటల వికర్షణ సిద్ధాంతాన్ని వివరించండి. దీని అనువర్తనాలు ఏమిటి ?
జవాబు:
సమయోజనీయ బంధ అణువుల ఆకృతులను వివరించడానికి, బాహ్య కర్పరంలోని ఎలక్ట్రాన్ జంటల మధ్య అన్యోన్య వికర్షణ చర్యలుంటాయనే భావన ప్రాతిపదికగా కొన్ని ప్రతిపాదనలు చేశారు.
ప్రతిపాదనలు :
ఒక అణువు ఆకృతి ఆ అణువు కేంద్ర పరమాణువు వేలన్స్ కర్పరంలోని బంధ, బంధరహిత ఎలక్ట్రాన్ జంటలపై
ఆధారపడి ఉంటుంది.
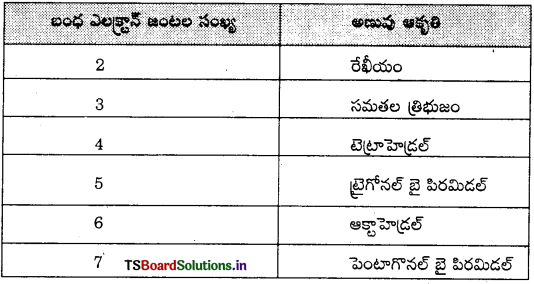
VSEPR సిద్ధాంతంలోని అంశాలు :
- అణువుల ఆకృతులు కేంద్రక పరమాణువు బాహ్య కర్పరంలో ఉన్న బంధ ఎలక్ట్రాన్ జంటల సంఖ్య మీద ఆధారపడి ఉంటాయి. కేంద్రక పరమాణువు మీద కేవలం బంధ జంటలు మాత్రమే ఉండి ఒంటరి జంటలు లేకపోయినట్లైతే అణువుకు స్థిరత్వం ఉండి క్రమ ఆకృతి ఏర్పడుతుంది.
- కేంద్రక పరమాణువు బాహ్య కర్పరంలో ఒంటరి ఎలక్ట్రాన్ జంటలు ఉంటే అణువు యొక్క ఆకృతిలో విరూపణ ఏర్పడటమే కాకుండా బంధ కోణంలో తగ్గుదల వస్తుంది.
- ఎలక్ట్రాన్ జంట మేఘాలు వాటి మధ్య వికర్షణ బలాలు కనిష్ఠంగా ఉండేటట్లుగా కేంద్రక పరమాణువు చుట్టూ వాటంతట అవి విస్తరించి ఉంటాయి.
- ఎలక్ట్రాన్ జంటల మధ్య గల వికర్షణ బలాల క్రమం ఈ క్రింది విధంగా ఉంటుంది. ఒంటరి జంట – ఒంటరి జంట > ఒంటరి జంట బంధ జంట > బంధ జంట – బంధ జంట
- బంధ ఎలక్ట్రాన్ జంటల మధ్య గల వికర్షణ బలాల పరిమాణాలు కేంద్రక పరమాణువుకు, దానితో బంధించబడిన ఇతర పరమాణువులకు మధ్య గల ఋణవిద్యుదాత్మకతల తేడా మీద ఆధారపడి ఉంటుంది.
- విభిన్న బంధాల మధ్య గల వికర్షణ క్రమం : ఈ క్రింది విధంగా ఉంటుంది.
త్రిబంధం > ద్విబంధం > ఏకబంధం. - కేంద్రక పరమాణువు చుట్టూ ఒంటరి ఎలక్ట్రాన్ జంట, బంధ ఎలక్ట్రాన్ జంట కన్నా ఎక్కువ ప్రదేశాన్ని ఆక్రమించి ఉంటుంది. కారణం ఏమనగా ఒంటరి ఎలక్ట్రాన్ జంట ఒకే ఒక్క కేంద్రక ఆకర్షణకు లోబడి ఉంటుంది. బంధ జంట రెండు కేంద్రకాల ఆకర్షణకు లోబడి ఉంటుంది.
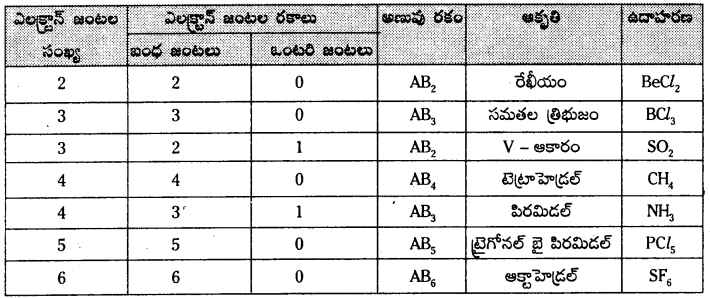
![]()
ప్రశ్న 47.
వేలన్స్ బంధ సిద్ధాంతాన్ని ఉపయోగించి అణువుల జ్యామితిని ఎలా వివరిస్తారు ?
జవాబు:
వేలన్స్ బంధ సిద్ధాంతంలోని అంశాలు :
- సగం నిండిన పరమాణు ఆర్బిటాళ్ళు పరస్పరం ఆవరింపు చేసుకోవడం వల్ల సమయోజనీయ బంధం ఏర్పడుతుంది.
- ఆవరింపులో పాల్గొనే సగం నిండిన పరమాణు ఆర్బిటాళ్ళలో ఎలక్ట్రాన్లు వ్యతిరేక స్పిన్లు కలిగి ఉండాలి. బంధంలో పాల్గొనే పరమాణువు తన ఆర్బిటాళ్ళ ఉనికిని పోగొట్టుకోలేదు. కాని అతిపాతం చెందే ఆర్బిటాల్లలోని ఎలక్ట్రాన్ జంటలను మాత్రం రెండు పరమాణువులు పంచుకుంటాయి.
- ఆర్బిటాళ్ళ ఆవరింపు పరిమితి మీద బంధ బలం ఆధారపడి ఉంటుంది. ఆవరింపు ఎక్కువగా ఉంటే బంధ బలం ఎక్కువగా ఉంటుంది. ఆవరింపు తక్కువగా ఉంటే బంధబలం తక్కువగా ఉంటుంది.
- ఆవరింపులో పాల్గొనే పరమాణు ఆర్బిటాళ్ళు ఎక్కువగా ఏ దిశలో కేంద్రీకృతం అవుతాయో ఆ దిశ ఏర్పడ్డ బంధం యొక్క దిశను సూచిస్తుంది.
- సంయోగం చెందే రెండు పరమాణువుల ఆర్బిటాళ్ళు అతిపాతం చెందడం వల్ల అంతర్ కేంద్ర అక్షంపై ఎలక్ట్రాన్ సాంద్రత పెరుగుతుంది. దీనివల్ల రెండు పరమాణువులు ఒకదానివైపు మరొకటి ఆకర్షితం అవుతాయి. దీని ఫలితంగా అణువు, స్థిరీకరణం చెందుతుంది.
- ‘s’ ఆర్బిటాల్ తప్ప మిగిలిన అన్ని పరమాణు ఆర్బిటాళ్ళు దిశను కలిగి ఉంటాయి. అందువలన అవి ఆవరింపు చేసుకోవడం వల్ల ఏర్పడే బంధానికి కూడా దిశ ఉంటుంది. ఇది అణువు యొక్క ఆకృతిని నిర్ణయిస్తుంది.
ఉదా : హైడ్రోజన్ అణువు ఏర్పడుట (s – s ఆవరింపు) : H పరమాణు సంఖ్య 1. కాబట్టి దాని ఎలక్ట్రాన్ విన్యాసం 1s1. దీనిలో సగం నిండిన ” ఆర్బిటాల్ ఉన్నది. రెండు H పరమాణువులు 1s ఆర్బిటాళ్ళు పరస్పరం అభిముఖం ఆవరింపు చేసుకోవడం వల్ల H2 అణువు ఏర్పడుతుంది. రెండు H పరమాణువుల మధ్య ఏర్పడే ఈ బంధాన్ని సిగ్మా సమయోజనీయ బంధం అంటారు. ఇది s – s ఆవరింపుకు ఉదాహరణ.
అణుజ్యామితులను వివరించుట :
ఉదా : మీథేన్.
- కార్బన్ పరమాణువుకు భూస్థితిలో ఎలక్ట్రాన్ విన్యాసం 1s22s22p2.
- ఉద్రిక్త స్థితిలో 1s22s1\(2 p_x^1 2 p_y^1 2 p_z^1\)
- కార్బన్ పరమాణువులో నాలుగు ఆర్బిటాళ్ళు ఒక్కొక్కటి ఒక జత కూడని ఎలక్ట్రాన్తో ఉన్నాయి.
- ఇవి నాలుగు హైడ్రోజన్ పరమాణువులలోని ఒక్కొక్క ఎలక్ట్రాన్లో ఉన్న 1s ఆర్బిటాల్పై అతిపాతం చెందుతుంది. దీనివల్ల నాలుగు C – H బంధాలు ఏర్పడతాయి.
- నాలుగో C – H బంధం s – s అతిపాతం వల్ల ఏర్పడుతుంది. ఈ బంధం ప్రత్యేకమైన దిశ కలిగినది కాదు. అందువల్ల బంధకోణాన్ని చెప్పలేము.
- ప్రయోగ ఫలితాలు మాత్రం ∠H C – H లు 109.5° గా చూపాయి.
- అంటే కేవలం పరమాణు ఆర్బిటాళ్ళ అతిపాతం ఆధారంగా బంధ కోణాలను వివరించలేం.
ప్రశ్న 48.
సంకరీకరణం అంటే ఏమిటి ? s, p ఆర్బిటాళ్ళతో జరిగే విభిన్న రకాల సంకరీకరణాలను వివరించండి.
జవాబు:
పరమాణువు బాహ్య కర్పరాలలోని దాదాపు సమానశక్తి గల ఆర్బిటాళ్ళు పూర్తిగా కలిసిపోయి కొత్తగా అదే సంఖ్యలో సమానశక్తి, ఆకృతిగల ఆర్బిటాళ్ళ సంఖ్యను ఏర్పరిచే పద్ధతినే సంకరీకరణం అంటారు.
సంకరీకరణ లక్షణాలు :
- సంకరీకరణంలో పాల్గొనేవి ఆర్బిటాళ్ళు. ఎలక్ట్రాన్లు కాదు.
- ఎన్ని పరమాణు ఆర్బిటాళ్ళు సంకరీకరణంలో పాల్గొంటాయో అదే సంఖ్యలో సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి.
- దాదాపు సమానశక్తి, స్థాయిల గల ఆర్బిటాళ్ళు కలిసి సంకర ఆర్బిటాళ్ళనిస్తాయి.
- ఏర్పడిన సంకర ఆర్బిటాళ్ళకు ఆకృతి, శక్తి సమానంగా ఉంటాయి.
- సంకర ఆర్బిటాళ్ళు పరమాణు ఆర్బిటాళ్ళ కంటే బలమైన బంధాల నేర్పరుస్తాయి. ఇది ఎక్కువ స్థిరమైన అణువులు ఏర్పడటానికి వీలుగా ఉంటుంది.
- సంకర ఆర్బిటాళ్ళు వాటి ఎలక్ట్రాన్ల మధ్య కనిష్ఠ వికర్షణ ఉండేటట్లుగా కేంద్రకం చుట్టూ ఉన్న ప్రదేశంలో దిశాత్మకంగా వ్యాప్తి చెంది ఉంటాయి.
1) sp3 సంకరీకరణం : ఒక ‘s’ ఆర్బిటాల్, మూడు ‘p’ ఆర్బిటాళ్ళు కలిసిపోయి నాలుగు sp3 సంకర ఆర్బిటాళ్ళను ఏర్పరిచే ప్రక్రియను sp3 సంకరీకరణం అంటారు.
ఒక్కొక్క sp3 సంకర ఆర్బిటాల్క \(\frac{1}{4}\)-s స్వభావం \(\frac{3}{4}\)-P స్వభావం ఉంటుంది. ఏ రెండు sp3 సంకర ఆర్బిటాళ్ళ మధ్య కోణమైన 109°28′ ఉంటుంది. కేంద్రక పరమాణువు sp3 సంకరీకరనం పొందే అణువులకు టెట్రాహెడ్రల్’.ఆకృతి ఉంటుంది.

ఉదా : మీథేన్ (CH4) అణువు ఏర్పడుట : మీథేన్ అణువు ఏర్పడేటప్పుడు కేంద్రక కార్బన్ పరమాణువు దాని ఉత్తేజిత స్థితిలో sp3 సంకరీకరణం పొందుతుంది. తత్ఫలితంగా దానిపై నాలుగు sp3 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. అట్లేర్పడ్డ నాలుగు సంకర ఆర్బిటాళ్ళలో బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. ఈ నాలుగు sp3 సంకర ఆర్బిటాళ్ళు నాలుగు H పరమాణువుల ‘1s’ ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకుని CH4 అణువును ఏర్పరుస్తాయి. CH4 అణువు టెట్రాహెడ్రల్ ఆకృతిని కలిగి ఉంటుంది. బంధకోణం 109°28′ ఉంటుంది.
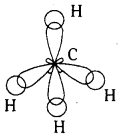
2) sp2 సంకరీకరణం : ఒక ‘S’ ఆర్బిటాల్, రెండు ‘p’ ఆర్బిటాళ్ళు కలిసిపోయి మూడు sp2 సంకర ఆర్బిటాళ్ళను ఏర్పరిచే ప్రక్రియను sp2 సంకరీకరణం అంటారు. ఒక్కొక్క sp2 సంకర ఆర్బిటాల్క \(\frac{1}{3}\)s – స్వభావం మరియు \(\frac{2}{3}\)p- స్వభావం ఉంటాయి. ఏ రెండు sp2 సంకర ఆర్బిటాళ్ళ మధ్య కోణమైనా 120° ఉంటుంది. కేంద్రక పరమాణువు sp2 సంకరీకరణాన్ని పొందే అణువులకు సమతల త్రిభుజాకృతి ఉంటుంది.
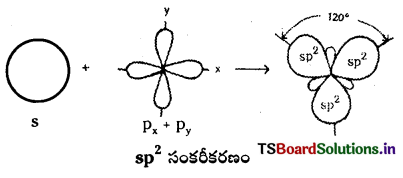
ఉదా : బోరాన్ ట్రై క్లోరైడ్ (BCl3) అణువు ఏర్పడుట :
BCl3 అణువు ఏర్పడేటప్పుడు కేంద్రక బోరాన్ పరమాణువు దాని ఉత్తేజిత స్థితిలో (1s22s1\(2 p_x^1 2 p_y^1 2 p_z^0\)) sp2 సంకరీకరణం పొందుతుంది. తత్ఫలితంగా దానిపై మూడు sp సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. అట్లేర్పడ్డ మూడు సంకర ఆర్బిటాళ్ళలోనూ బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. ఈ మూడు sp2 సంకర ఆర్బిటాళ్ళు మూడు క్లోరిన్ పరమాణువుల ‘3pz‘ ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకొని BCl3 అణువును యిస్తాయి. BCl3 అణువు సమతల త్రిభుజాకృతిని కలిగి ఉంటుంది. బంధకోణం 120°.
3) sp సంకరీకరణం : ఒక ‘s’ – ఆర్బిటాల్, ఒక ‘p’ – ఆర్బిటాల్ కలిసిపోయి రెండు sp సంకర ఆర్బిటాళ్ళను ఏర్పరిచే ప్రక్రియను ‘sp’ సంకరీకరణం అంటారు.
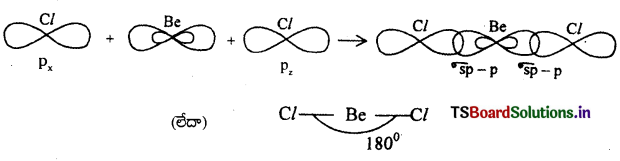
ఒక్కొక్క ‘sp’ సంకర ఆర్బిటాల్కు \(\frac{1}{2}\) s – స్వభావం మరియు \(\frac{1}{2}\) p – స్వభావం ఉంటాయి. ఏ రెండు sp సంకర ‘ఆర్బిటాళ్ళ మధ్య కోణమైన 180° ఉంటుంది. కేంద్రక పరమాణువు sp సంకరీకరణం పొందిన అణువులకు రేఖీయ ఆకృతి ఉంటుంది.

ఉదా : బెరీలియం క్లోరైడ్ (BeCl2) అణువు ఏర్పడుట:
బెరీలియం క్లోరైడ్ అణువు ఏర్పడేటప్పుడు కేంద్రక ‘Be’ పరమాణువు దాని ఉత్తేజిత స్థితిలో (1s22s1\(2 p_x^1 2 p_y^0 2 p_z^0\)). sp సంకరీకరణం పొందుతుంది. తత్ఫలితంగా రెండు sp సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. ఆ రెండింటిలోనూ బంధ ఎలక్ట్రాన్ జంటలు ఉంటాయి. ఇపుడు, రెండు sp సంకర ఆర్బిటాళ్ళు రెండు H పరమాణువుల 1s ఆర్బిటాళ్ళతో అభిముఖ ఆవరింపు చేసుకొని BeCl2 అణువును ఏర్పరుస్తాయి. BeCl2 అణువు రేఖీయ ఆకృతిని కలిగి ఉంటుంది. బంధకోణం 180° ఉంటుంది.
ప్రశ్న 49.
అణు ఆర్బిటాల్ సిద్ధాంతం ముఖ్య లక్షణాలను వ్రాయండి.
జవాబు:
అణు ఆర్బిటాల్ సిద్ధాంతం :
- పరమాణు ఎలక్ట్రానులు పరమాణు ఆర్బిటాళ్ళలో ఉన్నట్లు అణువు ఎలక్ట్రానులు అణు ఆర్బిటాళ్ళలో ఉంటాయి.
- సరియైన సౌష్ఠత, దాదాపు సమాన శక్తులు గల పరమాణు ఆర్బిటాళ్ళు కలిసిపోయి అణు ఆర్బిటాళ్ళనిస్తాయి.
- పరమాణు ఆర్బిటాల్క ఒకే కేంద్రకం ఉంటే అణు ఆర్బిటాల్క బహుకేంద్రకాలుంటాయి. అణు ఆర్బిటాల్లోని ఎలక్ట్రాన్ ఆ అణు ఆర్బిటాల్ ఏర్పరచిన పరమాణు కేంద్రకాలన్నింటివల్ల ప్రభావితమవుతుంది.
- ఎన్ని పరమాణు ఆర్బిటాళ్ళు కలుస్తాయో అదే సంఖ్యలో అణు ఆర్బిటాళ్ళు ఏర్పడతాయి. రెండు పరమాణు ఆర్బిటాల్లు కలిసి రెండు అణు ఆర్బిటాల్ల లనిస్తాయి. ఇందులో ఒకదాన్ని బంధక ఆర్బిటాల్ అని, రెండోదాన్ని అపబంధక ఆర్బిటాల్ అని అంటారు.
- బంధక ఆర్బిటాల్క్కు తక్కువ శక్తి, ఎక్కువ స్థిరత్వం ఉంటాయి. అపబంధక ఆర్బిటాల్క ఎక్కువ శక్తి, తక్కువ స్థిరత్వం ఉంటాయి.
- పరమాణు ఆర్బిటాల్ పరమాణు కేంద్రకం చుట్టూ ఎలక్ట్రాన్ సాంద్రత వితరణ సంభావ్యతను ఇస్తుంది. అణు ఆర్బిటాల్ అణుకేంద్రకాలన్నింటి చుట్టూ దానికి సంబంధించిన ఎలక్ట్రాన్ వితరణ సంభావ్యతనిస్తుంది.
- పరమాణు ఆర్బిటాళ్ళు ఆఫ్ బౌ, పౌలివర్జన లేదా మినహాయింపు సూత్రం, హుండ్ గరిష్ఠ బాహుళ్యతా నియమాలనను- సరించి, ఎలక్ట్రాన్లను నింపినట్లే అణు ఆర్బిటాళ్ళు కూడా ఈ నియమాల్ని పాటించి ఎలక్ట్రాన్లను నింపుతాయి.
- పరమాణు ఆర్బిటాళ్ళ రేఖీయ సంకలన పద్ధతిని ఒకే విధమైన కేంద్రకాలున్న రెండు పరమాణువుల (హైడ్రోజన్) అణువుకు వర్తింపచేస్తే
ψ అణు ఆర్బిటాల్ = ψA ± ψB
బంధక ఆర్బిటాల్ σ = ψA + ψB
అపబంధక ఆర్బిటాల్ σ* = ψA – ψB
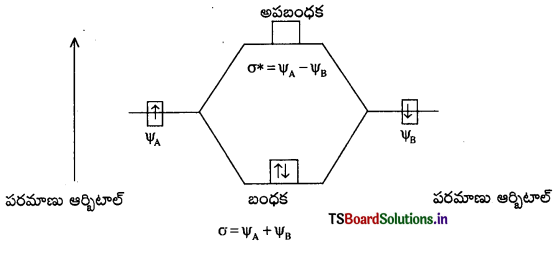
- అణు ఆర్బిటాళ్ళ సాపేక్ష శక్తులు : O2, F2 అణువుల ఆర్బిటాళ్ళ శక్తి స్థాయిల క్రమం

- బంధక్రమం : బంధక ఆర్బిటాల్లోని ఎలక్ట్రాన్ల సంఖ్య Na, అపబంధక అణు ఆర్బిటాల్లోని ఎలక్ట్రానుల సంఖ్య Nb, అయితే బంధక్రమం = \(\frac{1}{2}\)(Nb – Na) బంధక్రమం ధనాత్మకమైతే అణువు స్థిరం. అంటే (Nb – Na) లో Na < Nb. అలాగే బంధక్రమాంకం ఋణాత్మకం అయితే అప్పుడు Na > Nb ఈ సందర్భాలలోను అణువు స్థిరంగా వుండదు.
- అణువుల అయస్కాంత ధర్మాలను ఈ సిద్ధాంతం చక్కగా వివరించింది. ఆక్సిజన్ అణువు పరాయస్కాంత ధర్మాన్ని వివరించింది.
ప్రశ్న 50.
(a) N2, (b) O2 అణువులకు అణు ఆర్బిటాల్ శక్తి పటాలు వ్రాయండి. ఈ రెండు అణువుల అయస్కాంత లక్షణాలేమిటి ? వాటి బంధక్రమాలు గణించండి.
జవాబు:
నైట్రోజన్ పరమాణువు ఎలక్ట్రాన్ విన్యాసం 1s2 2s22p3. రెండు నైట్రోజన్ పరమాణువులు, వాటి పరమాణు ఆర్బిటాళ్ళ ఏకీయ కలయికతో అణు ఆర్బిటాళ్ళను ఏర్పరుస్తాయి.
N2 : అణు ఎలక్ట్రాన్ విన్యాసం.
![]()
బంధక్రమం \(\frac{10-4}{2}\) = 3, N2 అణువు డయా అయస్కాంత ధర్మం కలది.
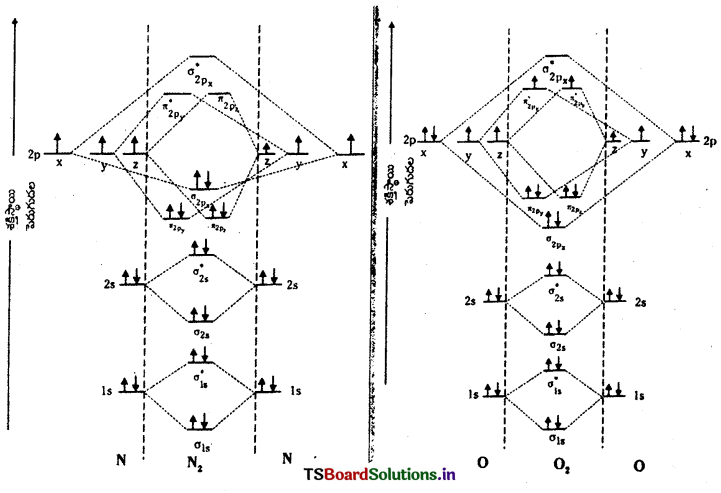
(b) O2 అణువులు ఏర్పడుట : ఆక్సిజన్ పరమాణు ఎలక్ట్రాన్ విన్యాసం 1s22s22p4. ఒక్కొక్క ఆక్సిజన్ పరమాణువుకు ఎనిమిది ఎలక్ట్రాన్లు పరమాణు ఆర్బిటాళ్ళలో ఉన్నాయి. రెండు ఆక్సిజన్ పరమాణువులు కలిసినపుడు ఆ రెండింటి పరమాణు ఆర్బిటాళ్ళ రేఖీయ కలయికతో అణు ఆర్బిటాళ్ళనిస్తాయి.
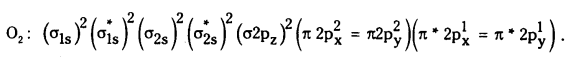
అణు ఎలక్ట్రాన్ విన్యాసంలో రెండు జతకూడని ఎలక్ట్రానులున్నాయి. అందువల్ల ఆక్సిజన్ అణువుకు పరాయస్కాంత ధర్మాలు ఉంటాయి.
బంధక్రమం : \(\frac{10-6}{2}\) = 2 (0 = 0)
అదనపు ప్రశ్నలు
ప్రశ్న 1.
నీరు అణువు ఆకృతిని వివరించండి.
జవాబు:
నీరు అణువు ఆకృతి : నీరు అణువు ఏర్పడేటప్పుడు కేంద్రక ఆక్సిజన్ పరమాణువు దాని ఉత్తేజిత స్థితిలో (1s22s2\(2 p_x^2 2 p_y^1 2 p_z^1\)) sp3 సంకరీకరణం పొందుతుంది. తత్ఫలితంగా దానిపై నాలుగు sp3 సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటిలో రెండింటిలో బంధ జంటలు మిగిలిన రెండింటిలో ఒంటరి జంటలు ఉంటాయి. కేంద్రక పరమాణువు sp3 సంకరీకరణం పొందడం వల్ల అణువుకు టెట్రాహెడ్రల్ ఆకృతి ఏర్పడాలి. కాని ఒంటరి ఎలక్ట్రాన్ జంటలు ఉండటం వల్ల VSEPR సిద్ధాంతం ప్రకారం అణువు యొక్క ఆకృతిలో విరూపణ వచ్చి అణువు పిరమిడల్ ఆకృతిని పొందుతుంది. బంధకోణం 109°28′ లకు బదులుగా 104°5 లకు తగ్గుతుంది.
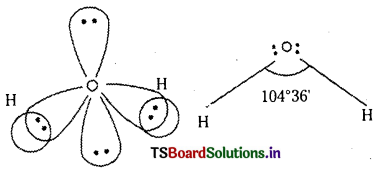
ప్రశ్న 2.
పరమాణు ఆర్బిటాళ్ళు, అణు ఆర్బిటాళ్ళు మధ్యగల తేడాలను రాయండి.
జవాబు:
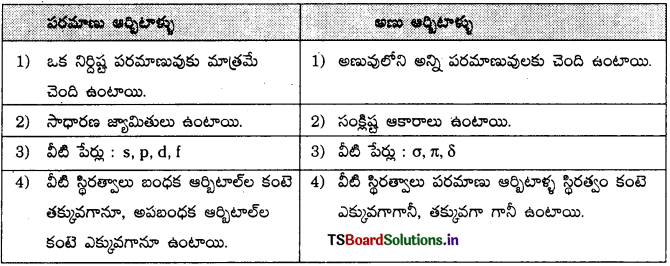
![]()
ప్రశ్న 3.
బంధక ఆర్బిటాల్, అపబంధక ఆర్బిటాల్లు అంటే ఏమిటి ?
జవాబు:
పరమాణు ఆర్బిటాళ్ళ శక్తి కంటే తక్కువ శక్తి స్థాయిలో ఉన్న అణు ఆర్బిటాళ్ళను బంధక ఆర్బిటాళ్ళు అంటారు. పరమాణు ఆర్బిటాళ్ళ శక్తి కంటే ఎక్కువ శక్తి స్థాయిలో ఉన్న అణు ఆర్బిటాళ్ళను అపబంధక ఆర్బిటాళ్ళు అంటారు.
ప్రశ్న 4.
H2 అణువు యొక్క MOED గీయండి.
జవాబు:
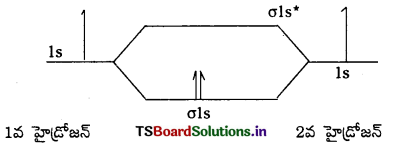
ప్రశ్న 5.
N, Cl ల ఋణవిద్యుదాత్మకతలు దాదాపుగా సమానంగా ఉన్నా NH3 బాష్పీభవన స్థానం HCl కంటె అధికంగా ఉంటుంది. ఎందుకు ?
జవాబు:
NH3లో హైడ్రోజన్ బంధాలు ఉంటాయి. HCl లో H – బంధాలు ఉండవు. అందువలన NH3 బాష్పీభవన స్థానం HCl కంటే అధికంగా ఉంటుంది.
ప్రశ్న 6.
NH3, H – బంధాలను ఇస్తుంది కాని HCl, H – బంధాలు ఇవ్వదు. ఎందుకు ?
జవాబు:
H-బంధాలను ఇవ్వాలంటే అధిక ఋణ విద్యుదాత్మకత విలువ గల మూలకం సైజు తక్కువగా ఉండాలి. క్లోరిన్ కంటె నైట్రోజన్ పరమాణువు సైజు చిన్నది. అందువల్ల NH3, H – బంధాలను ఇస్తుంది. HCl, H – బంధాలను ఇవ్వదు.
ప్రశ్న 7.
s, p – ఆర్బిటాల్లు ఏర్పరిచే వివిధ బంధాల బలాలను క్రమంలో రాయండి. అవి ఎపుడు సంకరీకరణం చెందుతాయి?
జవాబు:
వేలన్స్ బంధ సిద్ధాంతం ప్రకారం ఆవరింపు అవధి ఎంత ఎక్కువగా ఉంటే బంధం యొక్క బంధ బలం అంత ఎక్కువగా ఉంటుంది. ఇతర ఆర్బిటాళ్ళ కన్నా ‘p’ ఆర్బిటాళ్ళకు గల డంబెల్ ఆకృతి వలన వాటి ఆవరింపు అవధి ఎక్కువగా ఉంటుంది. ‘s’ ఆర్బిటాల్ గోళాకారంగా ఉండటం వలన వాటి ఆవరింపు అవధి తక్కువగా ఉంటుంది. కాబట్టి ఆవరింపు
క్రమం : p – p > s – p > s – s
సంకర ఆర్బిటాళ్ళ బంధశక్తి క్రమం: sp < sp2 < sp3.
VBT సిద్ధాంతం ప్రకారం అణువుల ఆకృతులను మరియు బంధకోణాలను వివరించలేము. అంతేకాకుండా VBT ప్రకారం అణువులో ఉండే అన్ని బంధాలకు శక్తి సమానంగా ఉండదు. అందువలన పరమాణు ఆర్బిటాళ్ళ సంకరీకరణ విధానాన్ని ప్రవేశపెట్టారు. ఈ ప్రక్రియలో ఒకే పరమాణువులోని ఆర్బిటాళ్ళు మాత్రమే పాల్గొంటాయి. అట్లేర్పడ్డ అన్ని సంకర ఆర్బిటాళ్ళు ఆకృతిలోనూ, శక్తిలోనూ మరియు దిగ్విన్యాసంలోనూ అన్ని విధాలా సమానంగా ఉంటాయి.
ప్రశ్న 8.
HF, NH3 ల బాష్పీభవన స్థానాలకంటే H2O బాష్పీభవన స్థానం ఎక్కువ. దానికి కారణాలు చెప్పండి.
జవాబు:
H2O మరుగు ఉష్ణోగ్రత HF కన్నా ఎక్కువకు కారణాలు :
- HF లో ఉన్న హైడ్రోజన్ బంధాల సంఖ్య కన్నా H2O లో ఉన్న హైడ్రోజన్ బంధాల సంఖ్య దాదాపు రెట్టింపు ఉంటుంది.
- బాష్ప స్థితిలో కూడా HF సహచరితంగా ఉంటుంది. (H6F6). కాని బాష్పస్థితిలో నీరు అణువులు విడివిడిగా ఉంటాయి.
NH3 కన్నా H2O మరుగు ఉష్ణోగ్రత ఎక్కువగుటకు కారణాలు :
- NH2 లో ఉన్న H బంధాల సంఖ్యకన్నా H2O లో ఉన్న H బంధాల సంఖ్య రెట్టింపు ఉంటుంది.
- నైట్రోజన్ యొక్క ఋణ విద్యుదాత్మకత తక్కువగా ఉండటం వల్ల NH3 అణువులలో H – బంధం శక్తి తక్కువగా ఉంటుంది.
ప్రశ్న 9.
HF > HBr > HCl బాష్పీభవన స్థానాల క్రమానికి కారణాలు ఊహించండి.
జవాబు:
- ద్రవస్థితిలో HF, H – బంధాల వలన (HF)2 గా ఉంటుంది. అందువలన HF యొక్క మరుగు ఉష్ణోగ్రత HCl మరియు HBr ల కన్నా ఎక్కువ.
- HBr మరియు HCl లు వాయువులు. HBr అణుభారం HCl అణుభారం కన్నా ఎక్కువ కాబట్టి, HBr యొక్క మరుగు ఉష్ణోగ్రత HCl కన్నా ఎక్కువ.
- HCl అత్యంత బాష్పశీల సమ్మేళనం. అందువలన మరుగు ఉష్ణోగ్రతల క్రమం HF > HBr > HCl గా ఉంటుంది.
![]()
ప్రశ్న 10.
ఇథిలీన్ అణువులో ఎన్ని సిగ్మా మరియు పై బంధాలు ఉన్నాయి ?
జవాబు:
ఇథిలీన్ అణువులో 5 సిగ్మా బంధాలు, ఒక పై బంధం ఉన్నాయి.
ప్రశ్న 11.
H2S కన్నా H2O మరుగు ఉష్ణోగ్రత ఎక్కువ. ఎందుకు ?
జవాబు:
H2O అణువులు ఒక దానితో ఒకటి H – బంధాల ద్వారా సహచరితం చెందుతాయి. కాని అట్టి అణువుల కలయిక (H– బంధాల ద్వారా) H2S లో ఉండదు. అందువలన H2O మరుగు ఉష్ణోగ్రత H2S కన్నా ఎక్కువగా ఉంటుంది.
ప్రశ్న 12.
KCl జల ద్రావణం విద్యుద్వాహకం కాగా BeCl2 జల ద్రావణం అవిద్యుద్వాహకం. ఎందువల్ల ?
జవాబు:
KClఅయానిక సమ్మేళనం కనుక అది జలద్రావణంలో K+, Cl– అయాన్లను యిస్తుంది. అందువల్ల అది విద్యుద్వాహకంగా పని చేస్తుంది. కాని BeCl2 సమయోజనీయ సమ్మేళనం. అది జల ద్రావణంలో అయాన్లను యివ్వదు. కనుక అది విద్యుద్వాహకం.
ప్రశ్న 13.
ఘన NaCl అవిద్యుద్వాహకం. కాని ద్రవ NaCl మంచి విద్యుద్వాహకం. ఎందువల్ల ?
జవాబు:
ఘన NaCl లో Na+ మరియు Cl– అయాన్లు బలమైన విద్యుదాకర్షణ బలాలచే స్ఫటిక జాలకంలో బంధింపబడి ఉంటాయి. ఇవి స్వేచ్ఛగా కదలలేవు. కనుక ఘన NaCl అవిద్యుద్వాహకం. కాని ద్రవ NaCl లో Na+, Cl– అయాన్లు స్వేచ్ఛగా చలిస్తూ ఉంటాయి. అందువలన ద్రవ NaCl విద్యుద్వాహకంగా పనిచేస్తుంది.
ప్రశ్న 14.
గది ఉష్ణోగ్రత వద్ద H2O ద్రవం కాగా H2 వాయువు. ఎందువల్ల ?
జవాబు:
H2O లో అణువుల మధ్య అంతరణుక H – బంధాలు ఉంటాయి. అందువల్ల నీరు అణువులు సహచరితంగా ఉంటాయి. కనుక H2O ద్రవస్థితిలో ఉంటుంది. కాని H2S లో అణువుల మధ్య H – బంధం ఉండదు. కనుక అది వాయు స్థితిలో ఉంటుంది.
ప్రశ్న 15.
బెరీలియంలో ఒంటరి ఎలక్ట్రాన్లు లేనప్పటికీ అది రెండు సమయోజనీయ బంధాలను ఎలా ఏర్పరచగలుగుతుందో తెలుపండి ?
జవాబు:
బెరీలియం పరమాణు సంఖ్య 4. కాబట్టి దాని ఎలక్ట్రాన్ విన్యాసం 1s22s2. దీనిని భూస్థితి విన్యాసం అంటారు. ఈ స్థితిలో ఒంటరి ఎలక్ట్రాన్లు లేవు. కాని బెరీలియం ఉత్తేజిత ఎలక్ట్రాన్ విన్యాసం 1s22s12p1. ఈ స్థితిలో రెండు ఒంటరి ఎలక్ట్రాన్లు ఉన్నాయి. కాబట్టి బెరీలియం రెండు సమయోజనీయ బంధాలను యిస్తుంది.
ప్రశ్న 16.
కార్బన్ట్రాక్లోరైడ్ సిల్వర్ నైట్రేట్ అవక్షేపాన్ని యివ్వదు. ఎందువల్ల ?
జవాబు:
కార్బన్ట్రాక్లోరైడ్ అధృవ సమయోజనీయ అణువు. అందువలన అది స్వేచ్ఛా క్లోరైడ్ (Cl–) అయాన్లను యివ్వలేదు. సిల్వర్ నైట్రేట్ అయానిక సమ్మేళనం. అది అయనీకరణం చెంది Ag+ అయాన్లను యిస్తుంది. కాని CCl4 నుండి Cl– అయాన్లు లభించకపోవడం వల్ల AgCl అవక్షేపం ఏర్పడదు.
ప్రశ్న 17.
అయానిక సమ్మేళనాలు అధిక కాఠిన్యతను కలిగి ఉండుటకు మరియు అధిక ద్రవీభవన, ఉష్ణోగ్రతలను కలిగి ఉండుటకు కారణం ఏమిటి ?
జవాబు:
అయానిక సమ్మేళనాలలో వ్యతిరేక విద్యుదావేశిత అయాన్లు బలమైన విద్యుదాకర్షణ బలాలతో స్పటిక జాలకంలో బంధింపబడి ఉంటాయి. అందువలన అవి అధిక కాఠిన్యతను మరియు అధిక ద్రవీభవన ఉష్ణోగ్రతను కలిగి ఉంటాయి.
ప్రశ్న 18.
అయానిక సమ్మేళనాలు దిశారహితంగా ఉంటాయి. కాని సమయోజనీయ సమ్మేళనాలు దిశాత్మకంగా ఉంటాయి. ఎందువలన ?
జవాబు:
వ్యతిరేక విద్యుదావేశిత అయాన్ల మధ్య ఆకర్షణ వల్ల అయానిక బంధం ఏర్పడుతుంది. వ్యతిరేక విద్యుదావేశిత అయాన్లు ఏ దిశలో ఒకదానికొకటి సమీపించినా వాటి మధ్య అయానిక బంధం ఏర్పడుతుంది. అందువల్ల అయానిక సమ్మేళనాలకు దిశ ఉండదు. బంధ ఎలక్ట్రాన్లు గల ఆర్బిటాళ్ళు అతిపాతం చేసుకోవడం వల్ల సమయోజనీయ బంధం ఏర్పడుతుంది. ఈ ఆర్బిటాళ్ళు ఒక నిర్దిష్ట దిశలో ఒకదానిని ఒకటి సమీపించినపుడే వాటి మధ్య సమయోజనీయ బంధం ఏర్పడుతుంది. అందువల్ల సమయోజనీయ బంధం దిశాత్మకంగా ఉంటుంది.
ప్రశ్న 19.
అయానిక సమ్మేళనాల మధ్య చర్యలు వేగంగా జరుగుతాయి. ఎందుకు ?
జవాబు:
అయానిక సమ్మేళనాలు వాటి జలద్రావణాలలో వ్యతిరేక విద్యుదావేశిత అయాన్లను యిస్తాయి. ఈ అయాన్లు అతి వేగంతో ప్రయాణిస్తూ ఉంటాయి. అందువల్ల అయానిక సమ్మేళనాల మధ్య చర్యలు వేగంగా జరుగుతాయి.
ప్రశ్న 20.
ఆల్కహాల్లో KCl కరగదు కాని అనార్ద్ర AlCl3 కరుగుతుంది. ఎందువల్ల ?
జవాబు:
అధృవ ద్రావణులలో అయానిక సమ్మేళనాలు కరగవు. కాని సమయోజనీయ సమ్మేళనాలు కరుగుతాయి. ఆల్కహాల్ అధృవ ద్రావణి KCl అయానిక పదార్థం. అందువల్ల KCl ఆల్కహాల్లో కరగదు. AlCl3 సమయోజనీయ సమ్మేళనం. కనుక అది ఆల్కహాల్లో కరుగుతుంది.
![]()
ప్రశ్న 21.
కర్పూరం కిరోసిన్లో కరుగుతుంది. కాని నీటిలో కరగదు. ఎందువల్ల ?
జవాబు:
సమయోజనీయ సమ్మేళనాలు అధృవ ద్రావణులలో కరుగుతాయి. కాని ధృవద్రావణులలో కరగవు. కర్పూరం సమయోజనీయ సమ్మేళనం. కనుక యిది అధృవ ద్రావణి అయిన కిరోసిన్లో కరుగుతుంది. కాని ధృవ ద్రావణి అయిన నీటిలో కరగదు.
ప్రశ్న 22.
a) BeCl2
b) BF3 అణువులలో కేంద్రక పరమాణువులు ఏ సంకరీకరణం పొందుతాయో తెలపండి.
జవాబు:
a) BeCl2 అణువులో కేంద్రక Be పరమాణువు sp సంకరీకరణం పొందుతుంది. అది రేఖీయ ఆకృతి కలిగి ఉంటుంది.
b) BF3 అణువులో కేంద్రక B పరమాణువు sp2 సంకరీకరణం పొందుతుంది. అది సమతల త్రిభుజాకృతి కలిగి ఉంటుంది.
ప్రశ్న 23.
ఆల్కహాల్ లేదా ఈథర్ మొదలయిన కర్బన ద్రావణాలలో LiCl కరుగుతుందా ? ఎందుకు ? ఎందుకు కాదు ?
జవాబు:
LiCl కోవేలంట్ స్వభావం గల పదార్థం. అందువలన అది అధృవ ద్రావణులైన ఆల్కహాల్, ఈథర్ లో కరుగుతుంది.
ప్రశ్న 24.
KCl ను అయానిక ఘనపదార్థంగా ఎందుకు భావిస్తారు ?
జవాబు:
K, Cl పరమాణువుల ఋణవిద్యుదాత్మక విలువల తేడా 2.2. ఇది 1.7 కన్నా ఎక్కువ. అందువలన KCl ను అయానిక ఘనపదార్థంగా భావిస్తాము.
ప్రశ్న 25.
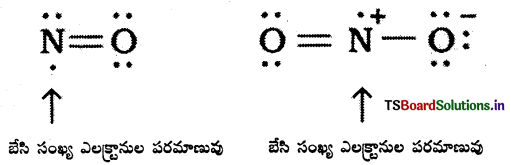
బేసి సంఖ్య ఎలక్ట్రాన్ అణువులకు ఉదాహరణ నివ్వండి.
జవాబు:
నైట్రిక్ ఆక్సైడ్ NO, నైట్రోజన్ డయాక్సైడ్ NO2 లాంటి అణువుల్లో కొన్ని పరమాణువుల చుట్టూ బేసి సంఖ్య ఎలక్ట్రాన్లుంటాయి. అష్టకనియమాన్ని పాటించవు.
ప్రశ్న 26.
ఫార్మల్ ఛార్జి లేదా ఫార్మల్ ఆవేశం :
జవాబు:
ఫార్మల్ ఛార్జి : స్వేచ్ఛా స్థితిలో పరమాణువు వేలన్స్ కర్పరంలో ఎలక్ట్రాన్ సంఖ్యకు, అయాను లేదా అణువు లూయీ నిర్మాణంలో ఆ పరమాణువుకు చూపించిన ఎలక్ట్రాన్ల సంఖ్యకు ఉన్న భేదమే.
ఒక లూయీ నిర్మాణంలో పరమాణువు ఫార్మల్ ఛార్జి = (స్వేచ్ఛా స్థితిలో పరమాణువులో ఉన్న వేలన్స్ ఎలక్ట్రాన్ల సంఖ్య) – (పరమాణువు మీద ఉన్న పంచుకోబడని ఎలక్ట్రాన్లు) – (పరమాణువు చుట్టూ ఉన్న బంధాల సంఖ్య)
1గా గుర్తింపబడిన కేంద్ర ఆక్సిజన్ పరమాణువుకు = 6 (పరమాణువు వేలన్స్ ఎలక్ట్రాన్లు ) – 2 (ఒక ఒంటరి జత ఎలక్ట్రానులు) – 3 (ఒక సమయోజనీయ బంధానికి 1)
= 6 – 2 – 3 = +1
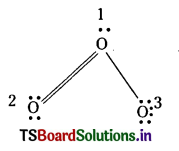
‘2’ గా గుర్తించిన ఒక చివరి ఆక్సిజన్ పరమాణువు ఫార్మల్ ఛార్జి = 6 – 4 – 2 = 0
‘3’ గా గుర్తించిన రెండో చివరి ఆక్సిజన్ పరమాణువు ఫార్మల్ ఛార్జి = 6 – 6 – 1 = -1
అందువల్ల O3 అణువును ఫార్మల్ ఛార్జితో బాటు చూపవలెను.
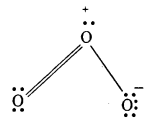
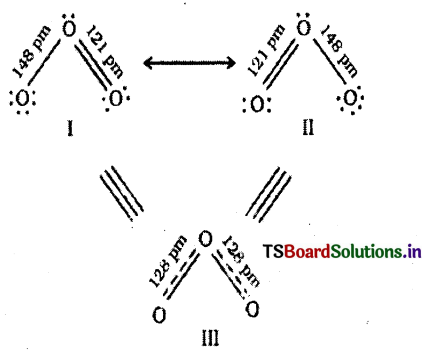
ప్రశ్న 27.
ఓజోన్ రెజోనెన్సు నిర్మాణాలు వ్రాయండి.
జవాబు: