Telangana TSBIE TS Inter 1st Year Chemistry Study Material 6th Lesson ఉష్ణగతిక శాస్త్రం Textbook Questions and Answers.
TS Inter 1st Year Chemistry Study Material 6th Lesson ఉష్ణగతిక శాస్త్రం
అత్యంత లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ఉష్ణగతిక శాస్త్రం అనే పదం ఏమి తెలియజేస్తుంది ?
జవాబు:
రసాయన, భౌతిక రసాయన, జీవరసాయన ప్రక్రియలలో ‘ఉష్ణానికీ, ఇతర రూపాలలోని ‘శక్తుల’కూ మధ్య ఉండే పరిమాణాత్మక సంబంధాలను గురించి రసాయనశాస్త్రంలో ఉండే ఈ విభాగాన్ని ఉష్ణగతికశాస్త్రము అంటారు.
ముఖ్యముగా ఉష్ణగతికశాస్త్రం అంటే “ఉష్ణం ప్రవహించడం”.
ప్రశ్న 2.
ఉష్ణగతికశాస్త్రం నియమాలకు, సమతాస్థితికి మధ్య సంబంధమేమిటి ?
జవాబు:
ఒక వ్యవస్థ సమతాస్థితిలో ఉన్నప్పుడు లేదా ఒక సమతాస్థితి నుంచి వేరొక సమతాస్థితికి మారుతున్నపుడు మాత్రమే ఉష్ణగతిక శాస్త్ర నియమాలు అనువర్తిస్తాయి.
గతిక సమతాస్థితి వద్ద గిబ్స్ శక్తి అత్యల్పంగా ఉంటుంది. గిబ్స్ శక్తి మార్పు Δr.\(\mathrm{G}^{\ominus}\)కు, సమతాస్థితి స్థిరాంకం ‘K’ కు ఉన్న సంబంధము
O = Δr.\(\mathrm{G}^{\ominus}\) + 7T ln K
లేదా Δr.\(\mathrm{G}^{\ominus}\) = – RT ln K
లేదా Δr.\(\mathrm{G}^{\ominus}\) = -2.303 RT log K.
![]()
ప్రశ్న 3.
వ్యవస్థను నిర్వచించండి. ఉదాహరణ ఇవ్వండి.
జవాబు:
ఉష్ణగతికశాస్త్ర అధ్యయనానికి ఎంచుకున్న విశ్వంలోని లఘుభాగాన్ని వ్యవస్థ అంటారు.
ఉదా : బీకరులో తీసుకొన్న నీరు, ఒక సిలిండర్లో ఉన్న వాయువు.
ప్రశ్న 4.
స్థిరోష్ణక గోడ ఉంది 4U = w Vact వ్యవస్థపరంగా ఉష్ణం, పని అంటే ఏమి అర్థమయింది ?
జవాబు:
వ్యవస్థ నుంచి పరిసరాలకు లేదా పరిసరాల నుంచి వ్యవస్థకు ఎలాంటి ఉష్ణశక్తి వినిమయమూ జరగని ప్రక్రియను స్థిరోష్ణక ప్రక్రియ అంటారు. ఈ ప్రక్రియలో పని జరిగినపుడు వ్యవస్థ యొక్క అంతరికశక్తి పెరుగుతుంది.
wad = U2 – U1 = ΔU
వ్యవస్థపై పని జరిగినపుడు, wad = ధనాత్మకం
వ్యవస్థ పనిచేసినపుడు, wad = ఋణాత్మకం.
ప్రశ్న 5.
వ్యవస్థ మీద పని ఏమీ జరగలేదు. వ్యవస్థ ‘q’ పరిమాణంలో ఉష్ణం కోల్పోయింది. ఈ వ్యవస్థ ఎలాంటి గోడను కలిగి ఉంది ?
జవాబు:
వ్యవస్థ ఉష్ణ వాహక గోడను కలిగి ఉంది. ఉష్ణవాహక గోడల ద్వారా ఉష్ణం బదిలీ అయితే, ΔU = q = TB – TA.
ఇచ్చట TA, TB లు ఉష్ణోగ్రతలు, q = బదిలీ అయిన ఉష్ణరాశి, ΔU = ఆంతరిక శక్తిలో మార్పు.
ప్రశ్న 6.
వ్యవస్థకు ‘q’ పరిమాణంలో ఉష్ణం అందించబడింది, వ్యవస్థ పనిచేసింది. ఈ వ్యవస్థ ఏ రకంపై ఎలాంటిదై ఉంటుంది ?
జవాబు:
‘W’ పరిమాణంలో వ్యవస్థ ద్వారా పని జరిగి, ‘q’ పరిమాణంలో ఉష్ణశక్తి వ్యవస్థకు ఇవ్వబడినపుడు, ΔU = q – W. ఇది సంవృత వ్యవస్థ. అంటే వ్యవస్థ నుండి పరిసరాలకు, లేదా పరిసరాల నుండి వ్యవస్థకు శక్తి మార్పిడి జరుగుతుంది. కాని ద్రవ్యమార్పు జరగదు.
ప్రశ్న 7.
ఒక ఆదర్శ వాయువు స్వేచ్ఛా వ్యాకోచంలో ఉత్ర్కమణీయ, అనుత్రమణీయ ప్రక్రియల్లో వాయువు చేసే పని ఏమిటి ?
జవాబు:
స్వేచ్ఛావ్యాకోచంలో (Pబాహ్య = 0) కాబట్టి పని ఏమీ జరగదు. ఈ వ్యాకోచం ఉత్రమణీయం కావచ్చు. లేదా అనుత్రమణీయం కావచ్చు.
ప్రశ్న 8.
సమీకరణం ΔU = q – pexΔV నుంచి ఘనపరిమాణం స్థిరంగా ఉన్నప్పుడు ΔU విలువ ఎంత ?
జవాబు:
ΔU = q-pex × ΔV సమీకరణంలో, ప్రక్రియను స్థిరఘనపరిమాణములో జరిపించినపుడు (ΔV = 0) అప్పుడు
ΔU = q అవుతుంది. అంటే అంతరిక శక్తిలో మార్పు = అందించబడిన ఉష్ణం.
ప్రశ్న 9.
సమోష్ణ స్వేచ్ఛా వ్యాకోచం ప్రక్రియలో ఒక ఆదర్శ వాయువు q, ΔU విలువలు ఎంత ?
జవాబు:
q, ΔU ల మధ్య సంబంధం ఈ క్రింది విధంగా ఉంటుంది. ΔU = q + w, సమోష్ణ స్వేచ్ఛా వ్యాకోచ ప్రక్రియలో w = 0, q = 0, ∴ ΔU = 0. కాబట్టి సమోష్ణ స్వేచ్ఛా వ్యాకోచ ప్రక్రియలో q, ΔU ల విలువలు శూన్యం (0) గా ఉంటాయి.
ప్రశ్న 10.
సమోష్ణ అనుత్రమణీయ ప్రక్రియ మార్పులో ఆదర్శవాయువుకు ‘q’ విలువ ఎంత ?
జవాబు:
ΔU = q + W సమీకరణాన్ని, సమోష్టక అనుత్రమణీయ మార్పులకు అన్వయిస్తే, అప్పుడు
q = – w = pబాహ్య × (Vతుది – Vతొలి)
![]()
ప్రశ్న 11.
ఆదర్శ వాయువు సమోష్ణ ఉత్రమణీయ మార్పులో ‘q’ విలువ ఎంత ?
జవాబు:
ఆదర్శ వాయువు సమోష్ణ ఉత్ర్కమణీయ మార్పులకు ‘q’ విలువ
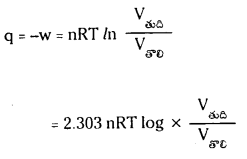
ప్రశ్న 12.
ఆదర్శ వాయువు స్థిరోష్ణక మార్పులో ΔU, w(adiabatic) ల సంబంధమేమిటి ?
జవాబు:
ΔU, W ల సంబంధం క్రింది విధంగా ఉంటుంది.
ΔU = q + w
ఆదర్శ వాయువు స్థిరోష్ణక మార్పుకు q = 0
అపుడు ΔU = w“స్థిరోష్ణక
ప్రశ్న 13.
ఉష్ణగతికశాస్త్రం మొదటి నియమం ఇవ్వండి.
జవాబు:
“శక్తిని సృష్టింపలేము, నశింపచెయ్యలేము. ఒక రూపములోని శక్తిని వేరొక రూపంలోకి మార్చగలము.” (లేదా) “మొదటి రకం సతతచలన యంత్రనిర్మాణము అసాధ్యం”. (లేదా)
“చక్రీయ ప్రక్రియలో వ్యవస్థ శక్తి మార్పు శూన్యం”.
ప్రశ్న 14.
వ్యవస్థ చేసిన పనికి, వ్యవస్థపై జరిగిన పనికి సంప్రదాయ గుర్తులు ఏమిటి ?
జవాబు:
ఒక వ్యవస్థ ద్వారా జరిగిన పనిని – pΔV తో సూచిస్తారు. అంటే వ్యవస్థ పనిచేస్తే దానిని ఋణ గుర్తుతో సూచిస్తారు. ఒక వ్యవస్థపై పని జరగడానికి + pΔV తో సూచిస్తారు. అంటే వ్యవస్థపై జరిగిన పనిని ధన గుర్తుతో సూచిస్తారు.
ప్రశ్న 15.
ఘనపరిమాణం (V), పీడనం (P), ఉష్ణోగ్రత (T) లు స్థితిప్రమేయాలు. ఇలా చెప్పడం సరైందా ?
జవాబు:
ఒక వ్యవస్థను ప్రభావితం చేసే అంశాలయిన పీడనం, ఘనపరిమాణం, ఉష్ణోగ్రత మొదలైన వాటి మీద ఆధారపడే ఉష్ణగతిక ప్రమేయాలను స్థితి ప్రమేయాలు అంటారు. ఇవి చర్యామార్గంపై ఆధారపడవు. కేవలం స్థితిపై ఆధారపడతాయి. కాబట్టి V, P, T లు స్థితి ప్రమేయాలే.
ప్రశ్న 16.
ఉష్ణం పరిసరాల నుంచి వ్యవస్థకు, వ్యవస్థ నుంచి పరిసరాలకు మారినపుడు దాని సంప్రదాయక గుర్తులు ఏమిటి ?
జవాబు:
పరిసరాల నుంచి వ్యవస్థకు, వ్యవస్థ నుంచి పరిసరాలకు ఉష్ణరాశి మార్పును ΔH తో సూచిస్తారు. ఒక చర్యలో వ్యవస్థ పరిసరాల నుంచి ఉష్ణం గ్రహిస్తే ΔH విలువ ధన గుర్తుతో సూచిస్తారు. అదే వ్యవస్థ పరిసరాలకు ఉష్ణం విడుదల చేస్తే ΔH విలువ ఋణ గుర్తుతో సూచిస్తారు.
ప్రశ్న 17.
పరిసరాల నుంచి వ్యవస్థ ఎలాంటి ఉష్ణం గ్రహించలేదు. అయితే వ్యవస్థ మీద పని జరిగింది. వ్యవస్థకు ఎలాంటి సరిహద్దు గోడ ఉంది ?
జవాబు:
వ్యవస్థపై పని జరుగుతుంది. కాని వ్యవస్థ ఉష్ణశక్తిని గ్రహించదు. ఈ వ్యవస్థ గోడను స్థిరోష్ణక గోడ అంటారు.
ΔU = wస్థిరోష్ణక
ప్రశ్న 18.
వ్యవస్థ మీద పని ఏమీ జరగలేదు. అయితే ‘q’ ఉష్ణం వ్యవస్థ నుంచి పరిసరాలకు మారింది. వ్యవస్థకు ఎలాంటి సరిహద్దు గోడ ఉంది ?
జవాబు:
వ్యవస్థ మీద పని జరగదు కానీ ‘q’ పరిమాణంలో వ్యవస్థ ఉష్ణశక్తిని పరిసరాలకు కోల్పోతే దానిని ఉష్ణవాహక గోడలు
అంటారు.
అప్పుడు ΔU = -q.
ప్రశ్న 19.
వ్యవస్థ పనిచేసింది, వ్యవస్థకు ‘q’ ఉష్ణం కూడా ఇవ్వబడింది. ఇది ఎలాంటి వ్యవస్థ ?
జవాబు:
‘w’ పరిమాణంలో వ్యవస్థ ద్వారా పని జరిగి ‘q’ పరిమాణంలో ఉష్ణశక్తి వ్యవస్థకు ఇవ్వబడినపుడు, ΔU = q – w. ఇది సంవృత వ్యవస్థ.
ప్రశ్న 20.
q = w = – Pext (υf – υi). ఇది అనుత్ప్ర్కమణీయ …… మార్పు.
జవాబు:
q = w = -Pబాహ్య (vతుది – vతొలి) అనేది అనుత్రమణీయ సమోష్ణక మార్పు.
ప్రశ్న 21.
q = – w = nRT ln (vf/vi). సమోష్ఠీయ …….. మార్పు.
జవాబు:
q = – w= nRT ln (vతుది /vతొలి) సమోష్ఠీయ ఉత్రమణీయ మార్పు.
ప్రశ్న 22.
1H కి ఉష్ణమోచక, ఉష్ణగ్రాహక చర్యల్లో సాంప్రదాయిక గుర్తులు ఏమిటి ?
జవాబు:
ఉష్ణమోచక చర్యలకు, AH విలువ ఋణాత్మకం.
ఉష్ణగ్రాహక చర్యలకు, AH విలువ ధనాత్మకం.
ప్రశ్న 23.
విస్తార (extensive), గహన (intensive) ధర్మాలంటే ఏమిటి ?
జవాబు:
పదార్థపు పరిమాణంపై ఆధారపడియుండే ధర్మాలను విస్తార ధర్మాలు అంటారు.
ఉదా : ద్రవ్యరాశి, ఘనపరిమాణము, అంతరికశక్తి, ఎంథాల్పీ మొదలగునవి. పదార్థం పరిమాణంతో సంబంధం లేని ధర్మాలను గహన ధర్మాలు అంటారు.
ఉదా : ఉష్ణోగ్రత, సాంద్రత, పీడనం మొదలగునవి.
ప్రశ్న 24.
సమీకరణం q = c · m · ΔT లో ΔT ఉష్ణోగ్రత మార్పు ‘m’ పదార్థం ద్రవ్యరాశి ‘q’ కావలసిన ఉష్ణం. అయితే ‘c’ ఏమిటి ?
జవాబు:
‘c’ ని ఉష్ణధారణ అంటారు.
“ఒక గ్రామ్ పదార్థం యొక్క ఉష్ణోగ్రతను 1°C పెంచుటకు అవసరమైన ఉష్ణాన్ని ఉష్ణధారణ అంటారు.
c = \(\frac{\mathrm{q}}{\Delta \mathrm{T}}\)
ప్రశ్న 25.
ΔU, ΔH ల సంబంధం తెలిపే సమీకరణం వ్రాయండి.
జవాబు:
ΔU, ΔH ల మధ్య సంబంధం సూచించే సమీకరణం
ΔH = ΔU + ΔnRT
ΔH = ఎంథాల్పీలోని మార్పు
ΔU = అంతరికశక్తులలో మార్పు
Δn = np – nR
[np = క్రియాజన్యాల మొత్తం మోల్ల సంఖ్య
nR = క్రియాజనకాల మొత్తం మోల్ల సంఖ్య].
R = సార్వత్రిక వాయు స్థిరాంకం
T = పరమ ఉష్ణోగ్రత.
ప్రశ్న 26.
Cp, Cυ ల మధ్య సంబంధం ఏమిటి ?
జవాబు:
ఒక ఆదర్శ వాయువుకు స్థిర ఘనపరిమాణం దగ్గర ఉష్ణధారణను CVగాను, స్థిర పీడనం దగ్గర ఉష్ణధారణను Cp గాను సూచిస్తే అప్పుడు వాటి మధ్య సంబంధం
CP – CV = R
R = వాయు స్థిరాంకం.
ప్రశ్న 27.
బాంబ్ కెలోరిమీటర్ ఆక్సిజన్ సమక్షంలో 298k, 1 atm పీడనంలో 1 gm గ్రాఫైట్ ఇచ్చిన సమీకరణం ప్రకారం దహనం చెందింది.
C(graphite) + O2(వా) → CO2(వా)
చర్య జరగడం వల్ల ఉష్ణోగ్రత 298K నుండి 299K కు పెరిగింది. బాంబ్ కెలోరిమీటర్ ఉష్ణధారణ 20.7 kJK-1, పై చర్యకు 298K, 1 atm పీడనం వద్ద ఎంథాల్పీ మార్పు ఎంత ?
జవాబు:
దత్తాంశం : Cp = 20.7 kJ
ΔT = 299 – 298 = 1k
సమీకరణం : ΔH = Cp × ΔT
ΔH = 20.7 × 1 = 20.7 kJ
ప్రశ్న 28.
పై చర్యకు అంతరిక శక్తి మార్పు ΔU ఎంత ?
జవాబు:
ΔU = ΔH – RΔT
= 20.7 – 8.314 × 10-3 (ΔT = 1)
= 20.7 – 0.08314
= 20.617 kJ.
![]()
ప్రశ్న 29.
CH4 (వా) + 2O2(వా) → CO2(వా) + 2H2O(ద్ర) చర్యకు క్రియాజనకాలు, క్రియాజన్యాల మోలార్ ఎంథాల్పీల ఆధారంగా చర్యోష్టం ΔrH ఎంత ?
జవాబు:
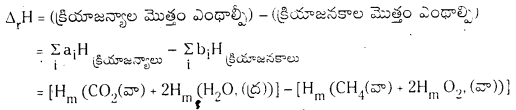
Hm = ఆయా పదార్ధాల మోలార్ ఎంథాల్పీల సంకేతం
ప్రశ్న 30.
కేవలం ఎంథాల్పీ తగ్గుదల మాత్రమే చర్య అయత్నీకృతానికి కారణం కాదు. ఎందువల్ల ?
జవాబు:
ఎంథాల్పీ తగ్గుదల (ΔH = ఋణాత్మకం) అయత్నీకృత ప్రక్రియకు కారణం కావచ్చు. కాని అన్ని సందర్భాలలో ఇది నిజం కాదు. ఎందులకనగా
- ΔH = ధనాత్మకంగా గల కొన్ని చర్యలు [\(\frac{1}{2}\)N2 (వా) + O2 (వా) → NO2 (వా), ΔH° = + 33.2 కి.జౌ. మోల్] అయత్నీ కృత చర్యలు
- ΔH = 0 అయినప్పటికి కొన్ని చర్యలు కూడా అయత్నీకృతంగా ఉన్నాయి.
- అయత్నీకృత చర్య ΔG అనే మరో అంశం మీద కూడా ఆధారపడి ఉంటుంది.
ప్రశ్న 31.
కేవలం ఎంట్రోపీ పెరుగుదల చర్య అయత్నీకృతానికి కారణం కాదు. ఎందువల్ల ?
జవాబు:
ఎంట్రోపీలో పెరుగుదల చర్య అయత్నీకృతం అవడానికి కారణం అనేది సరియైనది కాదు. ఎందుకంటే ఎంట్రోపీలో తగ్గుదల (ΔG = -ve) వల్ల కూడా చర్య అయత్నీకృతం అవుతుంది.
ప్రశ్న 32.
గిబ్స్ శక్తి మార్పు ΔG కు, సమతాస్థితి స్థిరాంకం ‘K’ కు మధ్య సంబంధం తెలపండి.
జవాబు:
గిబ్స్ సమీకరణము
Δr\(G^{\ominus}\) = -RT lnK
Δr\(G^{\ominus}\) = -2.303 RT log K.
ప్రశ్న 33.
Δ\(H^{\ominus}\), Δ\(S^{\ominus}\) లు తెలిస్తే Δ\(G^{\ominus}\) గణించవచ్చు. ఇది నిజమా ? కాదా ? ఎందువల్ల ?
జవాబు:
గిబ్స్ హెల్మ్హోల్ట్ సమీకరణము ప్రకారం
Δ\(G^{\ominus}\) = Δ\(H^{\ominus}\) – TΔ\(S^{\ominus}\)
ప్రమాణ ఉష్ణోగ్రత 298 k వద్ద ప్రమాణవిలువలు Δ\(H^{\ominus}\), Δ\(S^{\ominus}\) మరియు Δ\(G^{\ominus}\) గణించవచ్చు.
Δ\(H^{\ominus}\) మరియు Δ\(S^{\ominus}\) కనుగొనుట సాధ్యమైతే Δ\(G^{\ominus}\) ను కూడా పై సమీకరణం ద్వారా లెక్కించవచ్చు. కాబట్టి ఇవ్వబడిన ప్రతిపాదన నిజమే.
ప్రశ్న 34.
సమతాస్థితి స్థిరాంకం ‘K’ ని ప్రయోగశాలలో ఇచ్చిన ఉష్ణోగ్రత వద్ద ఖచ్చితంగా కొలిస్తే Δ\(G^{\ominus}\) ని వేరే ఏ ఉష్ణోగ్రత వద్దనన్నా కొలవవచ్చా ? ఎట్లా ?
జవాబు:
సమతాస్థితి స్థిరాంకం (K) మరియు Δ\(G^{\ominus}\) లు ఒకదానితో ఒకటి క్రింది విధంగా సంబంధితమై ఉంటాయి.
Δ\(G^{\ominus}\) = -2.303 RT log K.
ఇచ్చిన ఉష్ణోగ్రత వద్ద Kను నిర్ణయిస్తే, ఏ ఉష్ణోగ్రత వద్దనైనా పై సమీకరణం ఉపయోగించి Δ\(G^{\ominus}\) ను నిర్ణయించవచ్చును.
ప్రశ్న 35.
NO(వా) ఉష్ణగతిక స్థిరత్వాన్ని క్రింది చర్యల ఆధారంగా వివరించండి.
\(\frac{1}{2}\)N2(వా) + \(\frac{1}{2}\)O2(వా) → NO(వా), Δr\(H^{\ominus}\) = 90 kJ/mol-1
NO(వా) + \(\frac{1}{2}\)O2(వా) → NO2(వా), Δr\(H^{\ominus}\) = -74kJ/mol-1
జవాబు:
ఉష్ణమోచక పదార్థాలు స్థిరంగా వుంటాయి. అలాగే ఉష్ణగ్రాహ పదార్థాలు అస్థిరంగా వుంటాయి.
NO అనేది ఉష్ణగ్రాహ పదార్థం కాబట్టి అస్థిరంగా వుంటుంది.
NO2 అనేది ఉష్ణమోచక పదార్థం కాబట్టి స్థిరంగా వుంటుంది.
ప్రశ్న 36.
1.00 మోల్ H2O(ద్ర) ప్రమాణ పరిస్థితుల్లో ఏర్పడితే పరిసరాల ఎంట్రోపి మార్పు ఎంత ?
Δf\(H^{\ominus}\) H2O(l)] = -286 kJ/mol-1
జవాబు:
పరిసరాల ఎంట్రోపీ మార్పు
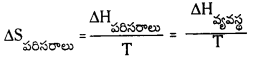
పరిసరాల ఎంథాల్పీ ఎంత పెరుగుతుందో వ్యవస్థ ఎంథాల్పీ అంతే తగ్గుతుంది.
= \(\frac{-286}{298}\) = \(\frac{286 \times 10^3}{298}\) -J/k = 1.0476 కి.జౌ. మోల్-1
ప్రశ్న 37.
ఒక చర్యకు సమతాస్థితి స్థిరాంకం విలువ 10. Δ\(G^{\ominus}\) విలువ ఎంత ?
R = 8.314 JK-1mol-1, T = 300 K.
జవాబు:
Δ\(G^{\ominus}\) = -2.303 RT log K
= -2.303 × 8.314 × 300 log 10
= – 2.303 × 8.314 × 300 × 1 = -5.744 Jk-1
ప్రశ్న 38.
ఉష్ణగతికశాస్త్రం మూడో నియమం ఏమిటి ?
జవాబు:
“పరిపూర్ణ శుద్ధ స్ఫటిక పదార్థాల ఎంట్రోపి విలువ పరమశూన్య ఉష్ణోగ్రత (0 K లేదా 273°C) సమీపించేకొద్దీ శూన్య విలువకు సమీపిస్తుంది”.
లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 39.
వివృత (open), సంవృత (closed), వివిక్త (isolated) వ్యవస్థలంటే ఏమిటి ? ఒక్కొక్కదానికి ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
- వివృత (లేదా) తెరచిన వ్యవస్థ : పరిసరాల నుంచి వ్యవస్థకు లేదా వ్యవస్థ నుంచి పరిసరాలకు శక్తి, ద్రవ్యం రెండూ మార్పిడి జరిగితే అటువంటి దానిని వివృత వ్యవస్థ అంటారు.
ఉదా : తెరచి ఉంచిన బీకరులో తీసుకున్న ద్రవం - సంవృత (లేదా) మూసిన వ్యవస్థ : వ్యవస్థ నుంచి పరిసరాలకు (లేదా) పరిసరాల నుంచి వ్యవస్థకు శక్తి మార్పిడి మాత్రమే జరిగితే అటువంటి వ్యవస్థను సంవృత వ్యవస్థ అంటారు.
ఉదా : మూసి ఉంచిన వాహక పాత్ర (రాగి లేదా స్టీలు పాత్ర)లో తీసుకున్న ద్రవం - వివిక్త (లేదా) బంధిత వ్యవస్థ : వ్యవస్థకు, పరిసరాలకు మధ్య శక్తి గానీ, ద్రవ్యం గానీ ఏదీ కూడా వినిమయం చెందని వ్యవస్థను వివిక్త వ్యవస్థ అంటారు.
ఉదా : థర్మాస్ ఫ్లాస్క్
ప్రశ్న 40.
స్థితిప్రమేయాలు (state functions), స్థితి చరాంశాలు (state variables) వీటిని నిర్వచించండి. ఉదాహరణ ఇవ్వండి.
జవాబు:
స్థితి ప్రమేయాలు : ఏ ధర్మాలు వ్యవస్థ యొక్క తొలి మరియు తుది స్థితులపై ఆధారపడి ఆ చర్య నడిచే మార్గముపై ఆధారపడవో వాటిని స్థితి ప్రమేయాలు అంటారు.
ఉదా : శక్తి, ఎంథాల్పీ, గిబ్స్ శక్తి
స్థితి చరాంశాలు : వ్యవస్థ గురించిన పూర్తి వివరణ ఇచ్చుటకు ఉపయోగపడే చరరాశులైన P, V, T లను స్థితి చరాంశాలు అంటారు.
ప్రశ్న 41.
“అంతరిక శక్తి ఒక స్థితి ప్రమేయం” వివరించండి.
జవాబు:
ఒక రసాయన వ్యవస్థలో మార్పు జరిగినప్పుడు ఎంత శక్తి విడుదలవుతుంది లేదా గ్రహించబడుతుందీ తెలుసుకోవడానికి
ఆ వ్యవస్థ మొత్తం శక్తిని తెలిపే పరిమాణాన్ని అంతరిక శక్తి అంటారు. దీనిని ‘U’ తో సూచిస్తారు.
ఈ క్రింది మార్పులు జరిగినపుడు వ్యవస్థ అంతరిక శక్తి ‘U’ లో మార్పు వస్తుంది.
- వ్యవస్థ పని చేసినప్పుడు లేదా వ్యవస్థపై పని జరిగినప్పుడు
- ఉష్ణశక్తి వ్యవస్థ నుంచి బయటకు లేదా బయట నుండి వ్యవస్థకు ప్రవహించినప్పుడు
- ద్రవ్యం వ్యవస్థ నుండి బయటకు లేదా బయట నుండి వ్యవస్థకు చేరేటప్పుడు
- అంతరిక శక్తి ‘U’ లో మార్పు వ్యవస్థ అనుసరించిన మార్గం మీద ఆధారపడదు. ఇది స్థితి ప్రమేయం. తొలి మరియు తుది స్థితులపై ఆధారపడి ఉంటుంది. కాబట్టి అంతరిక శక్తి స్థితి ప్రమేయం.
ప్రశ్న 42.
“పని స్థితి ప్రమేయం కాదు” వివరించండి.
జవాబు:
ఒక వ్యవస్థ ఒక స్థితి నుండి వేరొక స్థితికి మారినపుడు పని జరుగుతుంది. వ్యవస్థలో జరిగే ఈ స్థితి మార్పు వివిధ మార్గాలలో జరుగవచ్చు. కాబట్టి పని పరిమాణం వివిధ రకాలుగా ఉంటుంది. అన్ని మార్గాలలో జరిగే పని ఒకే విధంగా ఉండదు. అంటే జరిగే పని పరిమాణం వ్యవస్థ అనుసరించే మార్గం మీద ఆధారపడి ఉంటుంది. ఇది స్థితి ప్రమేయం కాదు. మార్గ ప్రమేయం.
ప్రశ్న 43.
ఉష్ణం అంటే ఏమిటో వివరించండి.
జవాబు:
భిన్న ఉష్ణోగ్రతల వద్ద ఉండే రెండు వస్తువుల మధ్య పరివర్తనం చెందే శక్తిని ఉష్ణం అంటారు.
ఉష్ణం అనేది శక్తి ఒక రూపం. ఇది మార్గ ప్రమేయం. స్థితి ప్రమేయం కాదు. దీనిని కెలోరి లేదా జౌళ్ళలో కొలుస్తారు. 1 కెలోరి = 4.18 జౌల్స్. దీనిని ‘q’ తో సూచిస్తారు. వ్యవస్థ నుండి పరిసరాలకు ఉష్ణం వినిమయం అయితే అపుడు ‘q’ విలువ ఋణాత్మకం. పరిసరాల నుండి వ్యవస్థ ఉష్ణం గ్రహించినపుడు ‘q’ విలువ ధన్మాతకం.
ప్రశ్న 44.
సమోష్ణక ఉత్రమణీయ చర్యకు ‘Wrev‘ ను ఉత్పాదించండి.
జవాబు:
-ఉత్రమణీయ పరిస్థితులలో పనిని P(వా) ను ఉపయోగించి క్రింది విధంగా వ్రాయవచ్చు.
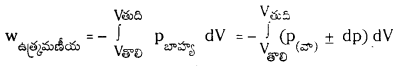
dp, dV విలువలు చాలా తక్కువ. అందువల్ల dp xdV ఇంకా తక్కువ కాబట్టి ఉపేక్షణీయం అవుతుంది.

![]()
ప్రశ్న 45.
10 atm పీడనం వద్ద 2L ఆదర్శ వాయువు సమోష్ణక విధానంలో 20L కు శూన్యంలోకి వ్యాకోచం చెందుతుంది. ఈ వ్యాకోచంలో ఎంత ఉష్ణం గ్రహించబడుతుంది ? ఎంత పని జరుగుతుంది ?
జవాబు:
వాయువు శూన్యంలోకి స్వేచ్ఛగా వ్యాకోచించింది. అప్పుడు పీడనం (P) = 0
Vతుది = 20L, Vతొలి = 2L
q = – w = p(Vతుది – Vతొలి)
= 0 (20 – 2) = 0
అంటే పని ఏమీ జరగదు. అదేవిధంగా ఉష్ణం ఏమీ గ్రహించబడదు.
ప్రశ్న 46.
పై సమస్యలోని ఆదర్శ వాయువులు 1 atm స్థిరపీడనానికి వ్యతిరేకంగా వ్యాకోచిస్తే ‘q’ విలువ ఎంత ?
జవాబు:
q = – w = Pబాహ్య(V2 – V1)
= 1 (20 – 2)
= 18 L. atm.
ప్రశ్న 47.
పై 45వ ప్రశ్నలోని ఆదర్శ వాయువు 10L ఘనపరిమాణానికి ఉత్రమణీయంగా వ్యాకోచం చెందితే ‘q’ విలువ ఎంత ?
జవాబు:
ఆదర్శ వాయువుకి PV = nRT
P = 10 atm.
V = 2L
10 × 2 = nRT
nRT = 20 L. atm
q = -w= 2.303 nRT log \(\frac{V_2}{V_1}\)
= 2.303 × 20 log \(\frac{20}{2}\)
= 46.06 L. atm
ప్రశ్న 48.
స్థితి ప్రమేయం ‘H’ ను వివరించండి. ΔU, ΔH ల మధ్య సంబంధం ఏమిటి ?
జవాబు:
- స్థిరపీడనం, ఉష్ణోగ్రతల వద్ద ఒక వ్యవస్థ పరిసరాలతో వినిమయం చేసుకొన్న ఉష్ణరాశి పరిమాణాన్ని ఎంథాల్పీ (H) అంటారు.
- ఒక ప్రక్రియను స్థిరపీడనం దగ్గర జరిపిస్తే, వ్యవస్థ ఘనపరిమాణం మారుతుంది. జరిగిన పని పీడనం – ఘ.ప పని అయితే w ను pΔV తో సూచిస్తారు.
- మొదటి నియమము ప్రకారము
ΔU = qp – pΔV = qp – p(V2 – V1)
U2 – U1 = qp – p (V2 – V1)
‘qp‘ స్థిరపీడనం దగ్గర గ్రహించిన ఉష్ణరాశి (U + pV) ను ఎంథాల్పీ అంటారు.
H = U + pV
qp = (U2 + pV2) – (U1 + pV1) - గ్రీకు పదం ఎంథాల్పీన్ అంటే వేడిచేయటం (లేదా) అంతర్గత ఉష్ణం.
qp = H2 – H1 = ΔH గా వ్రాయవచ్చు. - స్థిరపీడనం, స్థిర ఉష్ణోగ్రత వద్ద కలిగే శక్తి మార్పును ఎంథాల్పీ మార్పు (ΔH) అంటారు.
- ఎంథాల్పీ మాత్రం U, P, V ల మీద ఆధారపడి ఉంటుంది. ఇవన్నీ స్థితి ప్రమేయాలు. కాబట్టి ‘ΔH’ కూడా స్థితి ప్రమేయమే.
qp కూడా ప్రక్రియ మార్గంపై ఆధారపడదు.
qp స్థితి ప్రమేయం.
స్థిరపీడనం వద్ద పరిమితమైన మార్పులకు
ΔH = ΔU + ΔpV, ‘p’ స్థిరం కాబట్టి
ΔH = ΔU + pΔV
ప్రశ్న 49.
ΔH = ΔU + Δn (వా) RT ను ఉత్పాదించండి.
జవాబు:
ఒక చర్యలో వాయు క్రియాజనకాలు మాత్రమే పాల్గొంటే, క్రియాజనక వాయువుల మొత్తం ఘనపరిమాణం VA అనుకొనుము. చర్య జరిగిన తరువాత వచ్చిన వాయు క్రియాజన్యాలు మొత్తం ఘనపరిమాణం VB అనుకొనుము.
nA = వాయు క్రియాజనకాల మొత్తం మోల్లు
nB = క్రియాజన్యాల మోత్ల సంఖ్య
అపుడు pVA = nART, pVB = nBRT అగును.
pVB – pVA = nBRT – nART = (nB – nA) RT
(లేదా) p(VB – VA) = (nB – nA) RT
(లేదా) pΔV = Δn/gRT
Δn = nB – nA
pΔV విలువను ΔH = ΔV + pΔV సమీకరణంలో ప్రతిక్షేపిస్తే
ΔH = ΔU + ΔnRT అవుతుంది.
ప్రశ్న 50.
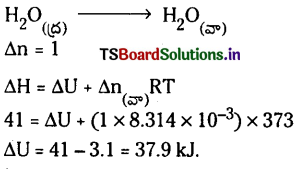
1 మోల్ నీటిని 1 bar పీడనం, 100°C వద్ద ఆదర్శ వాయువులా ప్రవర్తించే నీటిబాష్పం ఏర్పరిస్తే ఆ చర్యలో మోలార్ బాష్పీకరణ ఎంథాల్పీ 41 kJ/mol-1 క్రింది వాటికి అంతరికశక్తి మార్పును లెక్కకట్టండి.
a) 1 mole నీరు 1 bar, 100°C వద్ద బాష్పీకరణం చెందినప్పుడు
b) 1 mole నీరు ద్రవస్థితి నుంచి మంచుగా మారినప్పుడు
జవాబు:
a)
b)
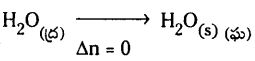
ఈ మార్పులో ఘనపరిమాణం మార్పు అతిస్వల్పం, పరిగణించదగింది కాదు. కాబట్టి
pΔV = Δn, RT ≈ 0 కాబట్టి
ΔH ≈ ΔU కాబట్టి ΔU = 41.00 kJ/mole
ప్రశ్న 51.
గహన, విస్తార ధర్మాలు వివరించండి.
జవాబు:
పదార్థ పరిమాణంపై ఆధారపడని ధర్మాలను గహన ధర్మాలు అంటారు.
ఉదా : పీడనం, సాంద్రత, బాష్పీభవన, ద్రవీభవన స్థానాలు, బాష్పపీడనం. పదార్థ పరిమాణంపై ఆధారపడు ధర్మాలను విస్తార ధర్మాలు అంటారు.
ఉదా : ఎంట్రోపి, ద్రవ్యరాశి, ఘనపరిమాణం, అంతరశక్తి, ఎంథాల్పీ, గిబ్స్ స్వేచ్ఛాశక్తి.
ప్రశ్న 52.
ఉష్ణధారణ అంటే ఏమిటి ? Cp – Cv = Rను ఉత్పాదించండి.
జవాబు:
ఒక పదార్థపు ఉష్ణోగ్రతను 1°C పెంచుటకు కావల్సిన ఉష్ణరాశిని ఉష్ణధారణ సామర్థ్యము అంటారు. దీనిని గణితం ప్రకారం క్రింది విధంగా సూచిస్తారు.
C = \(\frac{\mathrm{q}}{\mathrm{dT}}\)
Cp – Cv = R ఉత్పాదన :
ఆదర్శ వాయువుకు, H = E + pV
ఉష్ణోగ్రతాపరంగా అవకలనం చేస్తే

ప్రశ్న 53.
ΔU ను ప్రయోగపూర్వకంగా కెలోరిమెట్రిక్ విధానంలో ఏ విధంగా నిర్ణయిస్తారు ?
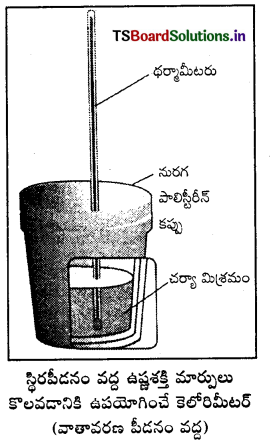
జవాబు:
అంతరికశక్తి మార్పు ΔU కొలిచే సాధనం : రసాయన చర్యల్లో స్థిర ఘనపరిమాణం వద్ద గ్రహించబడిన ఉష్ణాన్ని బాంబ్ కెలోరిమీటర్లో కొలుస్తారు. బాంబ్ కెలోరిమీటర్ ఒక దృఢమైన గోడలు గల ఉక్కుపాత్ర. ఇది ఒక జల పతాకంలో ముంచబడి వుంటుంది. ఈ మొత్తం పాత్రల అమరికనే కెలోరిమీటర్ అంటారు. తేలికగా దహనం చెందే పదార్థాన్ని ఉక్కు బాంబులో వుంచి ఆక్సిజన్ను కలిపి దహనం చేస్తారు.
చర్య ఉష్ణమోచకమై ఉష్ణం వెలువడుతుంది. ఇది కెలోరిమీటర్ ఉష్ణోగ్రతను పెంచుతుంది. బాంబ్ కెలోరిమీటర్ ఉష్ణబంధకం చేయబడి వుంటుంది. అందువల్ల కెలోరిమీటర్ నుంచి పరిసరాలకు ఉష్ణ వినిమయం జరగదు. బాంబ్ కెలోరిమీటర్ చర్య జరిగేటపుడు పూర్తిగా మూసివుంచబడి వుంటుంది. కాబట్టి దాని ఘనపరిమాణంలో మార్పు ఉండదు. అంటే చర్యలో శక్తి మార్పులు స్థిర ఘనపరిమాణంలో జరిగిన వాటిగా అనుకొని కొలతలు చేయాలి. స్థిర ఘనపరిమాణం అంటే ΔU = 0,
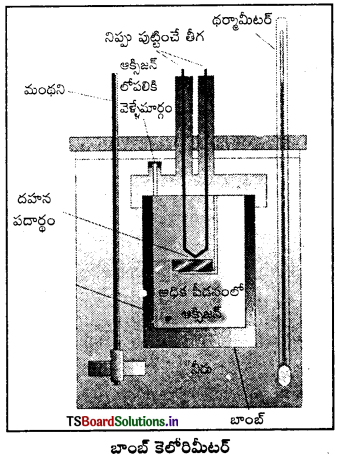
W = p ΔU = 0, అంటే చర్యలో పని ఏమీ జరగదు. చర్యలో వాయు పదార్థాలున్నప్పటికీ ఘనపరిమాణంలో మార్పురాదు. చర్య వల్ల కెలోరిమీటర్ పెరిగిన ఉష్ణోగ్రతను ఉపయోగించి కెలోరిమీటర్ ద్రవ్యరాశి, దాని ఉష్ణధారణ విలువల ద్వారా వెలువడిన ఉష్ణాన్ని (q1) క్రింది సమీకరణం ఉపయోగించి గణించవచ్చు.
విశిష్టోష్టణం × ద్రవ్యరాశి = ఉష్ణధారణ
q = C × m × ΔT = C × ΔT ఇచ్చట c × m = C
ప్రశ్న 54.
ΔH ను ప్రయోగపూర్వకంగా కెలోరిమెట్రిక్ విధానంలో ఏ విధంగా నిర్ణయిస్తారు ?
జవాబు:
స్థిరపీడనం వద్ద ఉష్ణశక్తి ΔH ని కొలవడం : మూత లేకుండా తెరచి వున్న కెలోరిమీటర్ సాధారణంగా వాతావరణ పీడనం దగ్గర వుంటుంది. వాతావరణ పీడనం స్థిరంగా వుంటుంది కాబట్టి కెలోరిమీటర్లో చర్య వల్ల వచ్చిన ఉష్ణ మార్పు స్థిరపీడనం వద్ద కొలిచిందిగా భావించవచ్చు. దీనిని రాస్తే ΔH కు సమానమవుతుంది. ΔH = qp. కాబట్టి స్థిరపీడనం వద్ద కొలిచిన ఉష్ణమార్పు చర్యోష్ణం (అది వెలువడిన ఉష్ణం కావచ్చు లేదా గ్రహించబడిన ఉష్ణం కావచ్చు.) లేదా చర్యా ఎంథాల్పి ΔrH అవుతుంది.
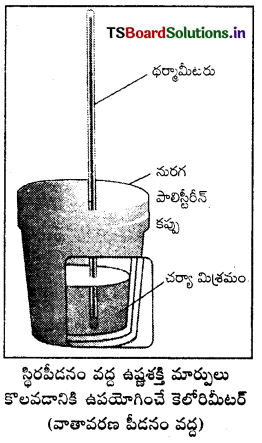
ఉష్ణమోచక చర్యలో ఉష్ణం వెలువడుతుంది. అంటే వ్యవస్థ నుంచి పరిసరాలకు ఉష్ణం ఇవ్వబడుతుంది. అందువల్ల qp రుణాత్మకమవుతుంది. ΔrH కూడా రుణాత్మకం. అదేవిధంగా ఉష్ణగ్రాహక చర్యలో వ్యవస్థ లేదా చర్య ఉష్ణం గ్రహిస్తుంది. అంటే పరిసరాల నుంచి చర్యకు ఉష్ణం ఇవ్వబడుతుంది. దీనికి qp ధనాత్మకం ΔrH కూడా ధనాత్మకమే.
ప్రశ్న 55.
చర్యా ఎంథాల్పీ అంటే ఏమిటి ? ప్రమాణ చర్యా ఎంథాల్పీని వివరించండి.
జవాబు:
చర్యా ఎంథాల్పీ-చర్యా ఎంథాల్పీ మార్పు ΔrH : ఒక రసాయన చర్యలో క్రియాజనకాలు క్రియాజన్యాలుగా మారతాయి.
క్రియాజనకాలు → క్రియాజన్యాలు
స్థాయికియోమెట్రిక్ సమీకరణం ప్రకారం క్రియాజనకాల మోల్లు చర్యలో పాల్గొన్నప్పుడు జరిగే ఎంథాల్పీ మార్పునే చర్యా ఎంథాల్పీ అంటారు. ఒక చర్య ఎంథాల్పీ మార్పును ΔrH సంకేతంతో చూపిస్తారు.
ప్రమాణ చర్యా ఎంథాల్పీలు : చర్యలో పాల్గొన్న అన్ని పదార్థాలు ప్రమాణ స్థితుల్లో వుంటే అప్పుడు ఆ చర్యా ఎంథాల్పీని ప్రమాణ చర్యా ఎంథాల్పీ అంటాం. ప్రమాణ చర్యా ఎంథాల్పీని Δ\(\mathrm{H}^{\ominus}\) గా అంటే ΔH సంకేతానికి తలమీద కుడిపైన ![]() గుర్తు రాస్తారు. 1 బార్ పీడనాన్ని ప్రమాణ పీడనంగాను, 298K ఉష్ణోగ్రతను ప్రమాణ ఉష్ణోగ్రతగాను తీసుకుంటారు.
గుర్తు రాస్తారు. 1 బార్ పీడనాన్ని ప్రమాణ పీడనంగాను, 298K ఉష్ణోగ్రతను ప్రమాణ ఉష్ణోగ్రతగాను తీసుకుంటారు.
![]()
ప్రశ్న 56.
“సంఘటనోష్ణం”ను నిర్వచించండి. ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
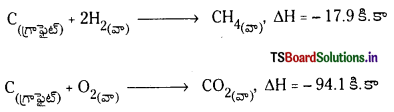
సంఘటనోష్ణం : స్థిర ఉష్ణోగ్రత వద్ద ప్రమాణస్థితిలో ఒక మోల్ సమ్మేళనం దాని అనుఘటక మూలకాల నుంచి (ప్రమాణ స్థితిలో) ఏర్పడినపుడు వెలువడే లేదా ఉద్గారించబడే ఉష్ణరాశిని సంశ్లేషణ ఉష్ణం అంటారు.
అనుఘటకాల నుంచి ఉష్ణం ఉద్గారం అయ్యే చర్యలో ఏర్పడే సమ్మేళనాలను ఉష్ణమోచక సమ్మేళనాలంటారు. అనుఘటకాల నుంచి సమ్మేళనం ఉష్ణగ్రాహక చర్య ద్వారా ఏర్పడినపుడు ఉష్ణగ్రాహక సమ్మేళనాలు అంటారు. అనుఘటక పదార్థాలు కూడా ప్రమాణస్థితిలో ఉంటే దానిని ప్రమాణ సంశ్లేషనోష్ణం అంటారు.
ఉదా :
ప్రశ్న 57.
ప్రావస్థ మార్పు ఎంథాల్పీని నిర్వచించి వివరించండి.
జవాబు:
ఒక ప్రావస్థ ఇంకొక ప్రావస్థకు మారినప్పుడు శక్తిని వ్యవస్థ గ్రహించడమో లేదా శక్తి పరిసరాలకు విడుదల కావడమో జరుగుతుంది. ఉదాహరణకు మంచును కరిగించి నీరుగా మార్చాలంటే ఉష్ణాన్ని మంచుకు ఇవ్వాలి. ఇది 273K వద్ద స్థిర పీడనం వద్ద జరుగుతుంది.
H2O(S) → H2O(l) : ∆fus\(\mathrm{H}^{\ominus}\) = 6.00 kJ mol-1
ఇక్కడ ∆ద్రవీభవన \(\mathrm{H}^{\ominus}\) ప్రమాణస్థితుల్లో ద్రవీభవన ఎంథాల్పీ. అదే 273K, 1 అట్మాస్ఫియర్ పీడనంలో నీరు ఘనీభవించి మంచుగా మారే ఉత్రమణీయ ప్రక్రియలో అదే ప్రమాణంలో ఉష్ణం పరిసరాలకు విడుదల అవుతుంది.
ప్రశ్న 58.
ద్రవీభవన ఎంథాల్పీ (మోలార్ ద్రవీభవన ఎంథాల్పీ)ని నిర్వచించి వివరించండి.
జవాబు:
ఒక మోల్ ఘనపదార్థాన్ని ప్రమాణ పరిస్థితుల్లో ద్రవీకరించినప్పుడు చెందే ఎంథాల్పీ మార్పును ప్రమాణ ద్రవీభవన మోలార్ ఎంథాల్పీ అంటారు. దీనిని ∆fus Hగా రాస్తారు.
H2(ఘ) → H2O(వా) ; ∆fus H° = 6.0 kJ
ప్రశ్న 59.
బాష్పీభవన ఎంథాల్పీ (మోలార్ బాష్పీభవన ఎంథాల్పీ)ని నిర్వచించి వివరించండి.
జవాబు:
ప్రమాణ స్థితిలో ఉన్న ఒక మోల్ ఘనపదార్థాన్ని ద్రవీభవనం చేయడానికి అవసరమయ్యే ఎంథాల్పీ మార్పును మోలార్ ద్రవీభవన ఎంథాల్పీ అంటారు.
ఉదా : H2O(ద్ర) → H2O(వా); ∆vap \(\boldsymbol{H}^{\ominus}\) = + 40.79 కి.జౌ. మోల్-1.
ప్రశ్న 60.
ప్రమాణ ఉత్పతన ఎంథాల్పీని నిర్వచించి వివరించండి.
జవాబు:
ప్రమాణ పీడనం మరియు స్థిర ఉష్ణోగ్రత వద్ద ఒక మోల్ ఘనపదార్థం ఉత్పతనం చెందినపుడు కలిగే ఎంథాల్పీ మార్పును ప్రమాణ ఉత్పతన ఎంథాల్పీ అంటారు.
ఉదా : CO2 (ఘ) → CO2(బాష్పం), ∆H° = + 25.2 కి.జౌ. మోల్-1
ప్రశ్న 61.
ప్రమాణ సంఘటనోష్ణం (సంశ్లేషణోష్ఠం) (∆r\(\boldsymbol{H}^{\ominus}\)) ను నిర్వచించి వివరించండి.
జవాబు:
ఒక మోల్ సంయోగపదార్థం దాని అత్యంత స్థిరమైన స్థితిలో, సంఘటిత మూలకాల నుంచి ఏర్పడినప్పుడు వచ్చే ప్రమాణ ఎంథాల్పీ మార్పునే ఆ సంయోగ పదార్థపు ప్రమాణ మోలార్ సంఘటన ఎంథాల్పీ లేదా ప్రమాణ మోలార్
సంఘటనోష్ణం అంటారు. దీనికి సంకేతం ∆f\(\boldsymbol{H}^{\ominus}\). అత్యంత స్థిరమైన సంఘటిత స్థితినే నిర్దేశ లేదా ప్రమాణ స్థితి అంటారు. ఒక మూలకం నిర్దేశ లేదా ప్రమాణ స్థితి అంటే ఆ మూలకపు అత్యంత స్థిరమైన 25°C వద్ద 1 బార్ పీడనం వద్ద వున్న సంఘటిత స్థితి. ప్రమాణస్థితిలో హైడ్రోజన్, ఆక్సిజన్, కార్బన్లు, వరుసగా H2(g) O2 (g) C(graphite) గా వుంటాయి.
C(graphite) + O2(g) → CO2(g); ∆H = -393.5 kJ
ప్రశ్న 62.
హెస్ స్థిరోష్ణ నియమాన్ని నిర్వచించి వివరించండి. (March 2013)
జవాబు:
ఒక రసాయన చర్య ఒక దశలో జరిగినా లేక అనేక దశల్లో జరిగినా ఆ చర్యలో జరిగే మొత్తం ఎంథాల్పీ మార్పు సమానంగా ఉంటుంది.
A అనే పదార్థం రెండు విభిన్న మార్గాల ద్వారా చర్య జరిపి D అనే పదార్థాన్ని ఇచ్చినదని అనుకోండి.
ఏకదశ : A → D; ∆H = Q
అనేక దశలు :
A → B; ∆H1 = q1
B → C; ∆H2 = q2
C → D; ∆H3 = q3
∆H1 + ∆H2 + ∆H3 = q1 + q2 + q3
హెస్ నియమం ప్రకారం Q = q1 + q2 + q3
ఉదా : CO2 (వా) ను C (గ్రా), O2 (వా) నుండి రెండు విధాలుగా పొందవచ్చు.
అనేకదశలలో మొత్తం ఎంథాల్పీ మార్పు = – 392.52 కి.జౌ
ఏకదశలో మరియు అనేక దశలలో ఎంథాల్పీ మార్పు సమానంగా ఉంది కాబట్టి ఈ ఉదాహరణ హెస్ నియమానికి అనుగుణంగా ఉన్నది.
ప్రశ్న 63.
దహనచర్య ఎంథాల్పీ (∆<sub.c\(H^{\ominus}\)) ను నిర్వచించి వివరించండి.
జవాబు:
ఒక మోల్ పదార్థం ప్రమాణస్థితుల్లో అధిక ఆక్సిజన్ సమక్షంలో దహనం చెంది పూర్తిగా ఆక్సీకరణం చెందినప్పుడు వచ్చిన క్రియాజన్యాలు కూడా ప్రమాణస్థితుల్లో వున్నప్పుడు ఆ దహన చర్యలో వెలువడిన ఉష్ణాన్ని ఆ చర్య యొక్క ప్రమాణ దహనచర్య ఎంథాల్పీ అంటారు.
ఉదా : C4H10 (వా) + \(\frac{13}{2}\)O2 (వా) → 4CO2 (వా) + 5H2O (ద్ర); ∆c\(H^{\ominus}\) = -2658.0 kJ mol-1
ప్రశ్న 64.
∆a\(H^{\ominus}\) , పరమాణీకరణ ఎంథాల్పీని నిర్వచించి వివరించండి.
జవాబు:
నిర్వచనం : అణువుల్లోని ఒక మోల్ బంధాలను పూర్తిగా విడగొట్టి తటస్థ పరమాణువులను ఏర్పరచేటప్పుడు కలిగే ఎంథాల్పీ మార్పును పరమాణీకరణ ఎంథాల్పీ అంటారు.
ఉదా : H -H బంధాల విచ్ఛిత్తి వల్ల హైడ్రోజన్ పరమాణువులు ఏర్పడుతున్నాయి. ఈ చర్యలో వచ్చే ఎంథాల్పీ మార్పును పరమాణీకరణ ఎంథాల్పీ, ∆a\(H^{\ominus}\) అంటారు.
H2(వా) → 2H(వా) ; ∆a\(H^{\ominus}\) = 435.0 kJ mol-1.
ప్రశ్న 65.
బంధ ఎంథాల్పీ (∆bond\(H^{\ominus}\)) నిర్వచించి వివరించండి.
జవాబు:
నిర్వచనం : వాయుస్థితిలో వున్న ఒక సమయోజనీయ పదార్థంలోని ఒక మోల్ సమయోజనీయ బంధాలను విచ్ఛిత్తిచేసి వాయుస్థితిలో వున్న క్రియాజన్యాలను ఇచ్చినప్పుడు జరిగిన ఎంథాల్పీ మార్పును బంధ నియోజన ఎంథాల్పీ అంటారు.
ఉదా : H2(g) → 2H (g); ∆H-H\(H^{\ominus}\) = 435.0 kJ mol-1
ఈ చర్యలో జరిగిన ఎంథాల్పీ మార్పు H – H బంధపు బంధ వియోజన ఎంథాల్పీ.
ప్రశ్న 66.
CH4 లోని C-H బంధ ఎంథాల్పీని వివరించండి.
జవాబు:
మీథేన్, (CH4) లో నాలుగు C – H బంధాలున్నాయి. ఇవన్నీ బంధ ధైర్ఘ్యం, బంధశక్తులకు సంబంధించి సమాన విలువలు కలిగి ఉంటాయి. అయితే బంధాల్ని ఒక్కొక్కటిగా విచ్ఛిత్తి చేస్తుంటే బంధశక్తి విలువలు మారతాయి.
CH4 (వా) → C (వా) + 4H; ∆a\(H^{\ominus}\) = 1665 kJ. mol-1
CH4 (వా) → CH3 (వా) + H; ∆bond\(H^{\ominus}\) = 427 kJ mol-1.
CH3 (వా) → CH2 (వా) + H; ∆bond\(H^{\ominus}\) = +439 kJ mol-1.
CH2 (వా) → CH (వా) + H; ∆bond\(H^{\ominus}\) = +452 kJ mol-1.
CH (వా) → C (వా) + H; ∆bond\(H^{\ominus}\) = +347 kJ mol-1.
కాబట్టి;
CH4 (వా) → C (వా) + 4H (వా) ; ∆a\(H^{\ominus}\) = 1665 kJ mol-1.
ఇలాంటి పరిస్థితుల్లో సగటు బంధశక్తి తీసుకోవాలి.
ఉదా : CH4, ∆C-H\(H^{\ominus}\) కు సగటు బంధశక్తి
∆C-H\(H^{\ominus}\) = 1/4(∆a\(H^{\ominus}\) = 1/4(1665 kJ mol-1) = 416 kJ mol-1
ప్రశ్న 67.
ద్రావణోష్ణం (∆sol\(H^{\ominus}\)), విలీన ప్రక్రియ ఉష్ణం (∆sol\(H^{\ominus}\)) లను నిర్వచించి వివరించండి.
జవాబు:
1. మోల్ ద్రావితాన్ని అధిక ద్రావణిలో సంపూర్ణంగా కరిగించినప్పుడు విడుదలైన లేదా గ్రహించబడ్డ ఉష్ణరాశి ప్రమాణమును ద్రావణోష్ణం అంటారు.
ఉదా : MgSO4 + నీరు → MgSO4 జ|| ద్రా.
స్థిర ఉష్ణోగ్రతా పీడనాల వద్ద 1 మోల్ ద్రావితం కరిగి వున్న ద్రావణానికి అధిక ద్రావణి కలిపి విలీనం చేసినపుడు జరిగే ఎంథాల్పీ మార్పును విలీనోష్ణం అంటారు.
ద్రావణి పరిమాణం మీద ఆధారపడి ద్రావణ ప్రక్రియలో ఎంథాల్పీ మార్పు ఉంటుంది. ఇంకా, ఇంకా ఎక్కువ ద్రావణి కలిపిన కొద్ది ఎంథాల్పీలో మార్పు ఏమీ ఉండదు.
ఉదా : HCl(వా) ను విలీన ప్రక్రియ చేసినపుడు ఎంథాల్పీ మార్పు
ΔH(40H2O) – ΔH(25H2O) = ΔH‘విలీనం
Δవిలీనం = [-72.79 -(-72.03)] kJ/mol = -0.76 kJ/mol.
ప్రశ్న 68.
అయొనైజేషన్ ఎంథాల్పీ, ఎలక్ట్రాన్ స్వీకరణ ఎంథాల్పీలను నిర్వచించండి.
జవాబు:
అయొనైజేషన్ ఎంథాల్పీ వాయుస్థితిలో ఉన్న ఒంటరి తటస్థ పరమాణువు బాహ్యకర్పరం నుండి ఒక ఎలక్ట్రాన్ను తొలగించి అయాన్ మార్చే సందర్భంలో కలిగే ఎంథాల్పీ మార్పును అయొనైజేషన్ ఎంథాల్పీ అంటారు.
ఉదా : Na (వా) → Na+ (వా) + ఎలక్ట్రాన్ ∆1\(H^{\ominus}\) = 496 కి.జౌ/మోల్
ఎలక్ట్రాన్ స్వీకరణ ఎంథాల్పీ : వాయుస్థితిలో ఉన్న ఒంటరి తటస్థ పరమాణువు అదనంగా ఒక ఎలక్ట్రాన్ను కలిగినపుడు కలిగే ఎంథాల్పీ మార్పును ఎలక్ట్రాన్ స్వీకరణ ఎంథాల్పీ (లేక) ఎలక్ట్రాన్ ఎఫినిటి అంటారు.
ఉదా : Cl(వా) + ఎలక్ట్రాన్ → Cl– (వా)
∆(eg)\(H^{\ominus}\) = – 348.6 కి.జౌ/మోల్
ప్రశ్న 69.
ఒక ప్రక్రియ అయత్నీకృతాన్ని వివరించండి.
జవాబు:
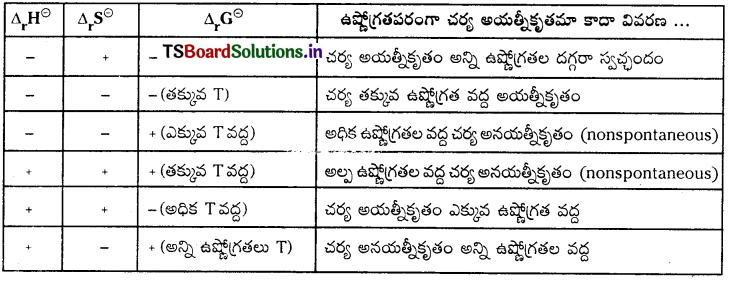
బాహ్యకారక ప్రమేయం లేకుండా చర్య స్వచ్ఛందంగా జరిగే ప్రక్రియను అయిత్నీకృతం అంటారు. ఇది అద్విగత చర్య. అన్ని సహజ ప్రక్రియలు అయత్నీకృత చర్యలే. ఎంథాల్పీలో తగ్గుదల అయత్నీకృత చర్యలకు ఒక అంశం. కాని ఇది అన్ని సందర్భాలలో నిజం కాదు. అయత్నీకృత చర్యలలో ఎంట్రోపీ పెరుగుతుంది. అయత్నీకృత చర్యలకు క్రింది మూడు నిశ్చిత పరిస్థితులు కావాలి.
- ΔH° = – (ఎంథాల్పీ మార్పు ఋణాత్మకం)
- ΔS° = + (ఎంట్రోపీలో మార్పు ధన్మాతకం)
- ΔG° = – (స్వేచ్ఛాశక్తిలో మార్పు ఋణాత్మకం).
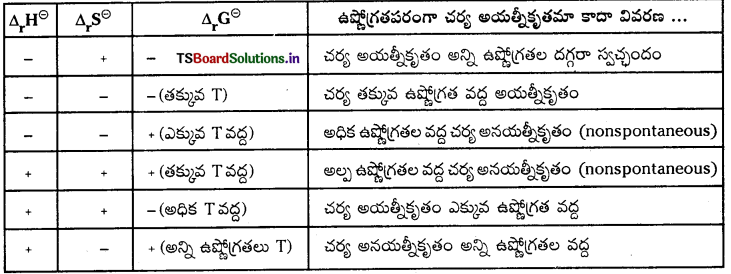
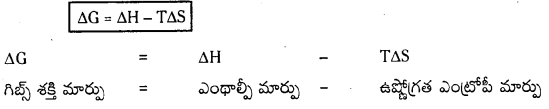
అయత్నీకృత చర్యల యొక్క నిబంధనను వివరించడానికి గిబ్స్ ఒక ఉష్ణగతిక ప్రమేయాన్ని ప్రవేశపెట్టాడు. దీనిని గిబ్స్ శక్తి అంటారు. గిబ్స్ సమీకరణం ప్రకారం, ΔG = ΔH – TΔS
అయత్నీకృత చర్యలు-నిబంధనలు :
చర్యల స్వచ్ఛందత లేదా అయత్నీకృతంపై ఉష్ణోగ్రత ప్రభావం
ప్రశ్న 70.
ఒక అయత్నీకృత ప్రక్రియకు కారణం ఎంథాల్పీ తగ్గుదల మాత్రమే కారణమా ? వివరించండి.
జవాబు:
ఎంథాల్పీలో తగ్గుదల, ∆H = -Ve, అనేది అయత్నీకృత చర్యలకు తోడ్పడే ఒక అంశమే గాని అన్ని సందర్భాలలో అది నిజం కాదు. ఎందుకంటే ఎంథాల్పీలో పెరుగుదల, ∆H =
Ve, ఉన్న కొన్ని చర్యలు అయత్నీకృతాలుగా ఉంటాయి.
ఉదా : \(\frac{1}{2}\) N2 (వా) + O2 (వా) → NO2 (వా) ∆<sub.rH° = + 33.2 కి.జౌ.
గిబ్స్ ప్రకారం, అయత్నీకృత చర్యలకు ∆G విలువ ఋణాత్మకంగా ఉండాలి. కాబట్టి అయతికృత చర్యలకు ఎంథాల్పీ తగ్గుదల మాత్రమే కారణం కాదు.
![]()
ప్రశ్న 71.
ఎంట్రోపీ అంటే ఏమిటి ? ఉదాహరణలతో వివరించండి.
జవాబు:
ఎంటోపి : ఒక వ్యవస్థలోని అణువుల క్రమరాహిత్యాన్ని తెలియచేసే దానిని ఎంట్రోపి అంటారు. వ్యవస్థలోని అణువుల క్రమరాహిత్యం పెరిగే కొలది ఎంట్రోపి పెరుగుతుంది. ఇది స్థితి ప్రమేయం ఒక వివిక్త వ్యవస్థలో జరిగే అయత్నీకృత ప్రక్రియకు ఎంట్రోపి మార్పు (∆S) ధనాత్మకంగా వుంటుంది.

ప్రశ్న 72.
ఎంట్రోపీ పెరుగుదలే అయత్నీకృత ప్రక్రియకు కారణం. వివరించండి.
జవాబు:
అయత్నీకృత చర్యకు ఎంట్రోపీలో పెరుగుదల అనేది ఒక అంశం మాత్రమే. అన్ని సందర్భాలలో కాదు. ఎంట్రోపీలో తగ్గుదల (∆S = – ve) ఉన్నపుడు తిరోగామి చర్య అయత్నీకృతంగా ఉంటుంది. ఎంట్రోపీలో మార్పు సున్న (∆S = 0) అయితే ఆ వ్యవస్థ సమతాస్థితిలో ఉంటుంది. ∆H = – ve, ∆S = + ve, ∆G = -ve అయితే అన్ని ఉష్ణోగ్రతల వద్ద చర్య అయత్నీకృతంగా ఉంటుంది.
ప్రశ్న 73.
∆U, ∆S ఉత్రమణీయ, అనుత్రమణీయ ప్రక్రియలను వివరించగలుగుతాయా ? వివరించండి.
జవాబు:
∆U అనేది అంతరికశక్తిలో మార్పు. ∆S అనేది ఎంటోపిలో మార్పు.
ఉష్ణమోచక చర్యలలో పురోగామి ప్రక్రియలో ∆U లో తగ్గుదల ఉంటుంది. ఈ సందర్భంలో ∆U అనే చర్య అయత్నీకృతకు అనుకూలం. ద్విగత చర్యలలో ∆U లో తగ్గుదల ఉండే దిశ చర్యకు అనుకూలంగా ఉంటుంది.
∆S విషయంలో ∆S = + ve అయితే చర్య అయత్నీకృతం.
∆S = -ve అయితే తిరోగామి చర్య అయత్నీకృతం, ∆S = 0 అయితే చర్య సమతాస్థితిలో ఉంటుంది.
∆U లేదా ∆H = -ve, ∆S = + ve, ∆G = -ve అయితే అన్ని ఉష్ణోగ్రతల వద్ద చర్య అయత్నీకృతం.
ప్రశ్న 74.
4Fe (ఘ) + 3O2 (వా) → 2Fe2O3 (ఘ) అనే ఐరన్ ఆక్సీకరణ చర్యకు 298K వద్ద ఎంట్రోపీ మార్పు -549.45 JK-1 mol-1, దీనికి రుణాత్మక ఎంట్రోపీ ఉన్నా చర్య అయత్నీకృతంగా జరుగుతుంది. ఎందువల్ల ?
జవాబు:
∆G = ∆H – T∆S
= 1648 × 103 J mol-1 – 298 (-549.45) = 1648 × 103 + 163 × 103 = -1485 × 103
∆G ఋణాత్మకం. అందువల్ల ఎంట్రోపీ మార్పు ఋణాత్మకంగా ఉన్నప్పటికీ చర్య అయత్నీకృతంగా జరుగుతుంది.
ప్రశ్న 75.
కింది వాటిల్లో ఏ ఫార్ములాలు సరైనవి ?
a) G = H – TS
b) ∆Gవ్యవస్థ = ∆Hవ్యవస్థ – T∆Sవ్యవస్థ
c)
![]()
d)
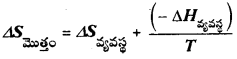
e)
T∆Sమొత్తం = T∆Sవ్యవస్థ – ∆Hవ్యవస్థ
జవాబు:
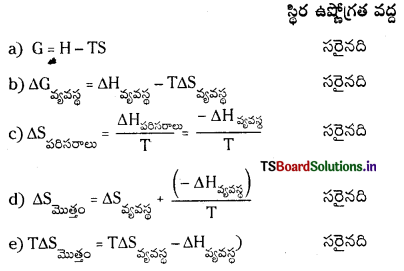
ప్రశ్న 76.
ఆక్సిజన్ను ఓజోన్గా మార్చడానికి ∆r\(\boldsymbol{G}^{\ominus}\) ను 298K వద్ద గణించండి. చర్య Kp విలువ 2.43 × 10-29.
జవాబు:
∆r\(\boldsymbol{G}^{\ominus}\) = -2.303 RT log Kp
Kp = 2.43 × 10-29
∆r\(\boldsymbol{G}^{\ominus}\) = -2.303 × 8.314 × 298 (log 2.43 × 10-24)
∆r\(\boldsymbol{G}^{\ominus}\) = 163 kJ
ప్రశ్న 77.
ఉష్ణగతికశాస్త్రం రెండో నియమాన్ని నిర్వచించి వివరించండి.
జవాబు:
క్లాసియస్ నిర్వచనం : విశ్వం యొక్క ఎంట్రోపీ గరిష్ఠంగా మారే దిశలో చర్చిస్తుంది.
లేదా
ఉష్ణశక్తి స్వచ్ఛందంగా చల్లని వస్తువు నుంచి వేడిగా గల వస్తువుకు ప్రసరించదు.
లేదా
పనిని పూర్తిగా ఉష్ణరాశిగా మార్చవచ్చు కానీ ఉష్ణరాశిని 100% పనిగా మార్చడం అసాధ్యం.
లేదా
అన్ని స్వచ్ఛంద చర్యల్లో ఎంట్రోపీ మార్పు ధనాత్మకం లేదా రెండోరకం సతతచలన యంత్ర నిర్మాణం అసాధ్యం.
ప్రశ్న 78.
ఉష్ణగతికశాస్త్రం మూడో నియమాన్ని నిర్వచించండి. దీనిని గురించి మీకు ఏమి తెలిసింది ?
జవాబు:
మూడవ నియమం:
పరిపూర్ణ శుద్ధ స్ఫటిక పదార్థాల ఎంట్రోపి విలువ పరమశూన్య ఉష్ణోగ్రత వద్ద శూన్యవిలువను కలిగి ఉంటుంది.
ST = \(\int_0^T \frac{C_p}{T} \cdot d T\) – సమీకరణం ఉపయోగించి, ఇవ్వబడిన ఉష్ణోగ్రత వద్ద Cp విలువ తెలిస్తే ఎంట్రోపి (S) విలువను లెక్కగట్టవచ్చు.
ప్రాముఖ్యత :
- ఈ నియమం సాయంతో చర్యల్లో ఎంట్రోపీ మార్పును నిర్ణయించవచ్చు.
- ఈ నియమం ప్రకారం ఏ స్వచ్ఛంద చర్యల్లో అయినా మొత్తం మీద ఎంట్రోపీ మార్పు ధనాత్మకంగా ఉండును.
- ఈ నియమం ఎంట్రోపి అవధిని గురించి తెలుపుతుంది.
ప్రశ్న 79.
ఎంట్రోపీ భావనను వివరించండి.
జవాబు:
ఎర్రటోపి : ఒక వ్యవస్థలోని అణువుల క్రమరాహిత్యాన్ని తెలియచేసే దానిని ఎంట్రోపి అంటారు. వ్యవస్థలోని అణువుల క్రమరాహిత్యం పెరిగే కొలది ఎంట్రోపి పెరుగుతుంది. ఇది స్థితి ప్రమేయం ఒక వివిక్త వ్యవస్థలో జరిగే అయత్నీకృత ప్రక్రియకు ఎంట్రోపి మార్పు (ΔS) ధనాత్మకంగా వుంటుంది.

ప్రశ్న 80.
గిబ్స్ శక్తిపరంగా ప్రక్రియ అయత్నీకృత మార్పును వివరించండి.
జవాబు:
గిబ్స్ శక్తి : ఇది ఉష్ణగతిక ప్రమేయం. దీనిలో ఎంథాల్పీ, ఎంట్రోపీ ప్రమేయాలు ఇమిడి వుంటాయి. ఒక చర్య స్వచ్ఛంద
చర్య ఔనో, కాదో తెలుసుకొనుటకు ఇది తగినంత, అవసర సమాచారాన్ని ఇస్తుంది. ఇది స్థితి ప్రమేయం.
గిబ్స్ సమీకరణం ప్రకారం
ΔG = ΔH – TΔS
ఇచ్చట ΔG = గిబ్స్ శక్తిలో మార్పు
ΔH = ఎంథాల్పీ మార్పు
TΔS = ఉష్ణోగ్రతతో ఎంట్రోపీ మార్పు.
ΔG, ఋణాత్మకమయిన స్వచ్ఛంధ చర్య. (ΔG < 0) GΔ, ధనాత్మకమైన అస్వచ్ఛంద చర్య. (ΔG > 0)
ΔG = 0, చర్య సమతాస్థితిలో ఉంటుంది.
ΔG = + ve, ΔS = + ve అయితే – ప్రక్రియ అయత్నీకృతం (TΔS > ΔH గా ఉండాలి.)
ΔG = – ve, ΔS = + ve, ΔH = – ve అయితే చర్య అన్ని ఉష్ణోగ్రతల వద్ద అయత్నీకృతం.
ప్రశ్న 81.
గిబ్స్ శక్తి మార్పు విలువ, గుర్తుల ఆధారంగా ఒక రసాయనిక చర్య అయత్నీకృత మార్పును, దాని నుంచి లభించే ఉపయోగకరమైన పనిని తెలుసుకోవచ్చు. దీన్ని వివరించండి.
జవాబు:
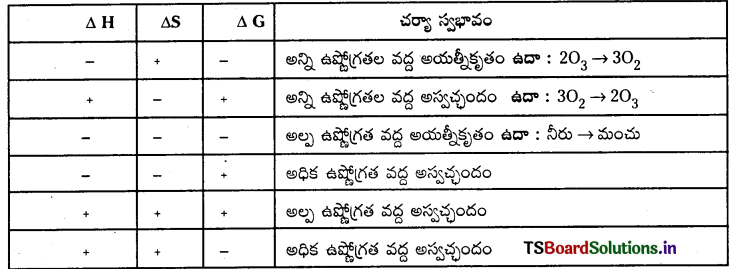
ఒక స్వచ్ఛంద చర్యకు “ΔG” గిబ్స్ శక్తి మార్పు విలువ ఋణాత్మకంగా ఉండవలెను. భిన్న చర్యల ΔH, ΔS మరియు ΔG విలువలు క్రింది విధంగా ఉండును.

గిబ్స్ శక్తిలో మార్పుకు, సమతాస్థితి స్థిరాంకం ‘K’ కు గల సంబంధాన్ని క్రింది సమీకరణం సూచిస్తుంది.
Δr\(\mathrm{G}^{\ominus}\) = Δr\(\mathrm{H}^{\ominus}\) – TΔr\(\mathrm{S}^{\ominus}\) = -RTlnK.
ఉష్ణగ్రాహక చర్యలకు ΔrH విలువ అధికంగా ఉండాలి మరియు ధనాత్మకంగా ఉండాలి (K < 1)
ఉష్ణమోచక చర్యలకు Δr° విలువ అధికంగా ఉండాలి మరియు ఋణాత్మకంగా ఉండాలి. (K > 1)
ప్రశ్న 82.
ఒక ప్రక్రియలో 701 J ల ఉష్ణం వ్యవస్థ గ్రహించగా వ్యవస్థ 394J పనిని చేసింది. వ్యవస్థ అంతరిక శక్తి మార్పు ఎంత ?
జవాబు:
dq = dU – dW
701 = dU – (- 394 J)
dU = 701 – 394 = 307 J
వ్యవస్థ అంతరిక శక్తి మార్పు = 307 J
ప్రశ్న 83.
సయనమైడ్ NH2CN, డైఆక్సిజన్ల మధ్య బాంబ్ కెలోరిమీటర్ 298K వద్ద చర్య జరిగితే ΔU = – 742.7 kJ mol-1. ఇదే ఉష్ణోగ్రత వద్ద ఎంథాల్పీ మార్పు ఎంత ?
NH2CN (వా) + \(\frac{3}{2}\) O2(వా) → N2(వా) + CO2(వా) + H2O(ద్ర)
జవాబు:
NH2CN (వా) + \(\frac{3}{2}\) O2(వా) → N2(వా) + CO2(వా) + H2O(ద్ర)
మొత్తం వాయుస్థితిలో ఉన్న క్రియాజనకాల మోత్ల సంఖ్య = 1 + 1.5 = 2.5
మొత్తం వాయుస్థితిలో ఉన్న క్రియాజన్యాల మోల్ల సంఖ్య = 1 + 1 + 0 = 2
Δn = 2 – 2.5 = – 0.5
ΔΗ = ΔU + ΔnRT
= – 742.7 + (0.5 × 8.314 × 10-3 × 298)
= -743.9 kJ
![]()
ప్రశ్న 84.
60g అల్యూమినియం ఉష్ణోగ్రతను 35°C నుంచి 55°C కు మార్చడానికి ఎన్ని KJ ఉష్ణం కావాలి ? అల్యూమినియం మోలార్ ఉష్ణధారణ = 24 J mol-1K-1.
జవాబు:
q = msdT
q = విడుదలయిన ఉష్ణం
m = అల్యూమినియం యొక్క ద్రవ్యరాశి
s = అల్యూమినియం మోలార్ ఉష్ణధారణ
dT = ఉష్ణోగ్రతలో వ్యత్యాసం
q = \(\frac{60}{27}\) × 24 × 20 = 1.067 కి.జౌ
ప్రశ్న 85.
1.0 mol నీటిని 10°C నుంచి మంచుగా – 10°C కు మార్చడానికి ఎంత ఎంథాల్పీ మార్పు తేవాలి ?
Δfus = 6.03 kJ mol-1 at 0°C 38.
Cp[H2O(ద్ర)] = 75.3J mol-1K-1
Cp[H2O(ఘ)] = 36.8 J mol-1K-1
జవాబు:
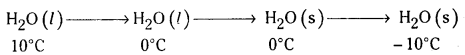
1st step ఉష్ణం విడుదలయినది ΔH = nCpdT = – 75.3 × 10 = – 753 J
2nd step ఉష్ణం విడుదలయినది ΔH = -6.0312 J
3rd step ఉష్ణం విడుదలయినది ΔH = nCpdT = + 36.8 × 10 = + 368 J
∴ ΔH = -6.03 + (−0.753) + (+ 0.368) = – 6.415 kJ
ప్రశ్న 86.
C(ఘ) ను CO2గా మార్చడానికి దహనక్రియ ఎంథాల్పీ – 393.5 kJ mol-1. కార్బన్, డై ఆక్సిజన్ వాయువు నుంచి 35.2 g CO2 ఏర్పడినప్పుడు విడుదలయ్యే ఉష్ణశక్తి ఎంత ?
జవాబు:
C (వా) + O2 (వా) → CO2 (వా), ΔH = -393.5 కి.జౌ
1 మోల్ CO2 (44 గ్రా) CO2 ఏర్పడేటపుడు విడుదలయ్యే ఉష్ణం = – 393.5 కి.జౌ
35.2 గ్రా. CO2 ఏర్పడేటపుడు విడుదలయ్యే ఉష్ణం =\(\frac{35.2}{44}\) × -393.5 = -314.8 జౌ.
ప్రశ్న 87.
CO(వా), CO2(వా), N2O(వా), N2O4(వా)ల సంఘటన ఎంథాల్పీలు వరుసగా 9.7 kJ mol-1. కింది చర్య ΔrH విలువ కనుక్కోండి.
N2O4 (వా) + 3CO(వా) → N2O(వా) + 3CO2(వా)
జవాబు:
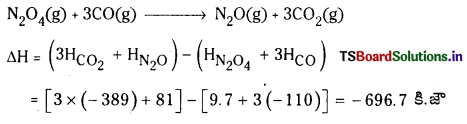
ప్రశ్న 88.
N2(వా) + 3H2(వా) → 2NH3(వా) ; Δr\(\mathrm{H}^{\ominus}\) = – 92.4 kJ mol, అయితే అమ్మోనియా ప్రమాణ సంఘటన ఎంథాల్పీ ఎంత ?
జవాబు:
ఉష్ణం యొక్క చర్య Δr \(\mathrm{H}^{\ominus}\) is – 92.4 kJ mol-1
పైన పేర్కొన్న సమీకరణం 2 మోల్స్ యొక్క అమ్మోనియా ఏర్పడటానికి అవసరమయిన ఉష్ణశక్తి.
ఒక్క మోల్ అమ్మోనియా ప్రమాణ సంఘటన ఎంథాల్పీ
NH3 = \(\frac{-92.4}{2}\) = – 46.2 kJ
∴ అమ్మోనియా ప్రమాణ సంఘటన ఎంథాల్పీ = – 46.2 kJ
ప్రశ్న 89.
CH3OH (ద్ర) ప్రమాణ సంఘటన ఎంథాల్పీని కింది చర్యల ద్వారా గణించండి.
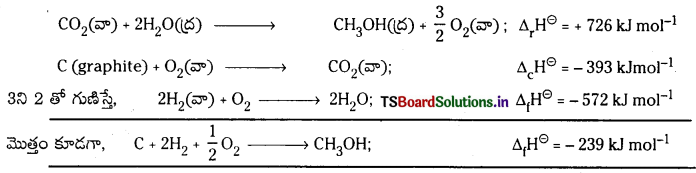
CH3OH (ద్ర) + \(\frac{3}{2}\)O2(వా) → 2H2O(ద్ర); Δr\(\boldsymbol{H}^{\ominus}\) = -726 kJ mol-1
C(గ్రాఫైట్) + O2(వా) → CO2(వా) ; Δc\(\boldsymbol{H}^{\ominus}\) = -393 kJ mol-1
H2(వా) + \(\frac{1}{2}\)O2(వా) → H2O(ద్ర); Δf\(\boldsymbol{H}^{\ominus}\) = -286 kJ mol-1
జవాబు:
ఇచ్చిన దత్తాంశం నుండి
1. CH3OH (ద్ర) + \(\frac{3}{2}\)O2(వా) → CO2(వా) + 2H2O(ద్ర); Δr\(\mathrm{H}^{\ominus}\) = -726 kJ mol-1
2. C (graphite) + O2(వా) → CO2(వా); Δc\(\mathrm{H}^{\ominus}\) = – 393 kJ mol-1
3. H2(వా) + \(\frac{1}{2}\)O2(వా) → H2O(ద్ర); Δf\(\mathrm{H}^{\ominus}\) = – 286 kJ mol-1
1ని ఉత్రమణీయం చేస్తే,
ప్రశ్న 90.
CCl4(వా) → C(వా) + 4 Cl(వా) చర్యకు ఎంథాల్పీ మార్పు గణించండి.
CCl4 లోని C – C బంధానికి బంధ ఎంథాల్పీ ఎంత ?
Δvap\(H^{\ominus}\)(CCl4) = 30.5 kJ mol-1.
Δr\(H^{\ominus}\) (CCl4) = − 135.5 kJ mol-1.
Δa\(H^{\ominus}\)(C) = 715.0 kJ mol-1, ఇక్కడ Δa\(H^{\ominus}\) అనేది పరమాణీకరణ ఎంథాల్పీ,
Δa\(H^{\ominus}\)(Cl2) = 242 kJ mol-1
జవాబు:
C(s) + 2Cl2(వా) → CCl4(ద్ర)
ΔrH° = [ΔH ఉత్పన్నాలు] – [ΔH క్రియాజనకాలు]
= 715 + 484 + 135.5 – 30.5
= 1334.5 – 30.5 = 1304 కి.జౌ.
∴ C – Cl బంధ ఎంథాల్పీ = \(\frac{1304}{4}\) = 326 కి.జౌ.
ప్రశ్న 91.
ఒక వివిక్త వ్యవస్థ ΔU = 0 అయితే ΔS ఏమవుతుంది ?
జవాబు:
ఇవ్వబడిన వివిక్త వ్యవస్థకు ΔU = 0
ΔH = ΔU + ΔnRT
∴ ΔH = ΔnRT
ΔS = \(\frac{\Delta \mathrm{H}}{\mathrm{T}}\) = \(\frac{\Delta \mathrm{nRT}}{\mathrm{T}}\)
∴ ΔS > 0 (లేక) ΔS = + ve
ప్రశ్న 92.
298 K వద్ద 2A + B → C చర్యకు ΔH = 400 kJ mol-1 ΔS = 0.2 kJ K-1 mol-1 ఉష్ణోగ్రతా విస్తృతిలో ΔH, ΔS లు స్థిరంగా ఉంటాయనుకొంటే ఏ ఉష్ణోగ్రత వద్ద చర్య అయత్నీకృతం అవుతుంది ?
జవాబు:
సమతాస్థితి వద్ద ΔG = 0
Tequi = \(\frac{\Delta \mathrm{H}}{\Delta \mathrm{S}}\) = \(\frac{400}{0.2}\) = 2000 K
2000 °K వద్ద ప్రక్రియ అయత్నీకృతం అవుతుంది.
ప్రశ్న 93.
2Cl(వా) → Cl2(వా) చర్యకు ΔH, ΔS ల గుర్తులు ఇవ్వండి.
జవాబు:
బంధం ఏర్పడినప్పుడు శక్తి విడుదలవుతుంది.
∴ ΔH = – ve
ఈ ప్రక్రియలో 2 క్లోరిన్ ఆటమ్స్ కలిసి ఒక Cl2 అణువుగా ఏర్పడతాయి. ఇది ఉష్ణమోచక చర్య ఎంట్రోపీ తగ్గుతుంది.
∴ ΔS = – ve
ప్రశ్న 94.
2A (వా) + B(వా) → 2D(వా) చర్యకు 4\(U^{\ominus}\) = -10.5 kJ, Δ\(S^{\ominus}\) = – 44.1 JK-1 చర్యకు 25°C వద్ద Δ\(\boldsymbol{G}^{\ominus}\) విలువ ఎంత ? చర్య అయత్నీకృతమా, కాదా ?
జవాబు:
ΔH = ΔU + ΔngRT
ΔH = -10.5 + (-1) × 8.314 × 10-3 × 298
= -12.97 kJ
ΔG = ΔH – TΔS
= -12.97 – 298 (-44.1 × 10-3) = 0.164 kJ
ΔG = ధనాత్మకం (ΔG > 0 ). కావున చర్య అయత్నీకృతం కాదు.
ప్రశ్న 95.
ఒక చర్యకు 300K సమతాస్థితి స్థిరాంకం 10. దీనికి Δ\(\boldsymbol{G}^{\ominus}\) విలువ ఎంత ? R = 8.314 JK-1mol-1.
జవాబు:
Δ\(\boldsymbol{G}^{\ominus}\) = -2.303 RT log Kp
= -2.303 × 8.314 × 300 × 1 = – 5.744 kJ/mol
ప్రశ్న 96.
ఉష్ణగతికశాస్త్రం ప్రథమ నియమం నిర్వచించండి. దాని గణితరూప సమీకరణం రాయండి.
జవాబు:
ఉష్ణగతికశాస్త్ర ప్రథమ నియమం : “శక్తిని సృష్టింపలేము నశింపచెయ్యలేము. ఒక రూపములోని శక్తిని వేరొక రూపంలోకి మార్చగలము”.
లేదా
“మొదటిరకం సతతచలన యంత్ర నిర్మాణం అసాధ్యం”
లేదా
“చక్రీయ ప్రక్రియలో వ్యవస్థ శక్తి మార్పు శూన్యం”
ఒక వ్యవస్థ తొలి అంతరశక్తి EA అని వ్యవస్థ గ్రహించిన ఉష్ణరాశి Q అని, వ్యవస్థ చేసిన పని “w”, అని దాని తుది అంతరికశక్తి EB అని అంతరిక శక్తిలోని మార్పు ΔE అని అనుకుంటే
ΔE = EB – EA = Q – w
⇒ Q = ΔE + w
దీనినే ఉష్ణగతిక శాస్త్ర ప్రథమ నియమపు గణితాత్మక రూపం అంటారు.
![]()
ప్రశ్న 97.
ఉష్ణగతికశాస్త్రం రెండో నియమానికి ఏవైనా రెండు వేరువేరు నిర్వచనాలు ఇవ్వండి.
జవాబు:
క్లాసియస్ నిర్వచనం : విశ్వం యొక్క ఎంట్రోపీ గరిష్ఠంగా మారేదిశలో చలిస్తుంది.
లేదా
ఉష్ణశక్తి స్వచ్ఛందంగా చల్లని వస్తువు నుంచి వేడిగా గల వస్తువుకు ప్రసరించదు.
లేదా
పనిని పూర్తిగా ఉష్ణరాశిగా మార్చవచ్చు కానీ ఉష్ణరాశిని 100% పనిగా మార్పులు అసాధ్యం.
లేదా
అన్ని స్వచ్ఛంద చర్యలో ఫలిత ఎంట్రోపీ మార్పు ధనాత్మకం లేదా రెండోరకం సతతచలన యంత్ర నిర్మాణం అసాధ్యం.
ప్రశ్న 98.
గిబ్స్ శక్తిని వివరించండి.
జవాబు:
గిబ్స్ శక్తి : ఇది ఉష్ణగతిక ప్రమేయం. వీనిలో ఎంథాల్పీ ఎంట్రోపీ ప్రమేయాలు ఇమిడి వుంటాయి. ఒక చర్య స్వచ్ఛంద చర్య ఔనో, కాదో తెలుసుకొనుటకు ఇది తగినంత, అవసర సమాచారాన్ని ఇస్తుంది. ఇది స్థితి ప్రమేయం.
ప్రశ్న 99.
చర్య అయత్నీకృతాన్ని గిబ్స్ శక్తితో వివరించండి.
జవాబు:
ఒక స్వచ్ఛంద చర్యకు “ΔG” గిబ్స్ శక్తి మార్పు విలువ ఋణాత్మకంగా ఉండవలెను. భిన్న చర్యల ΔH, ΔS మరియు ΔG విలువలు క్రింది విధంగా ఉండును.
గిబ్స్ శక్తి మార్పు. (ΔG) కు, ఎంథాల్పీ మార్పు (ΔH) కు గల సంబంధం ఈ క్రింది విధంగా రాస్తారు.
ΔG = ΔH – TΔS
ΔG = + ve అయితే (ΔG > 0) ఆ చర్య అయత్నీకృత చర్య
AG = – ve అయితే (ΔG – 0) ఆ చర్య అనయత్నీకృత చర్య
ΔG = 0 అయితే ఆ చర్య సమతాస్థితిలో ఉంటుంది.
ΔG = + ve, ΔS = + ve అయితే – ప్రక్రియ అయత్నీకృతం (TΔS > ΔH గా ఉండాలి.)
ΔG = – ve, ΔS = + ve, ΔH = – ve అయితే ఆ చర్య అన్ని ఉష్ణోగ్రతల వద్ద అయత్నీకృతం.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 100.
హెస్ స్థిర ఉష్ణ సంకలనం నియమం నిర్వచించి వివరించండి. ఉదాహరణ ఇవ్వండి.
జవాబు:
ఒక రసాయన చర్య ఒక దశలో జరిగినా లేక అనేక దశల్లో జరిగినా ఆ చర్యలో జరిగే మొత్తం ఎంథాల్పీ మార్పు సమానంగా ఉంటుంది.
A అనే పదార్థం రెండు విభిన్న మార్గాల ద్వారా చర్య జరిపి అనే పదార్థాన్ని ఇచ్చినదని అనుకోండి.
ఏకదశ : A→ D; ΔH = Q
అనేక దశలు :
A → B; ΔH1 = q1
B → C; ΔH2 = q2
C → D; ΔH3 = q3
ΔH1 + ΔH2 + ΔH3 = q1 + q2 + q3
హెన్ నియమం ప్రకారం Q = q1 + q2 + q3
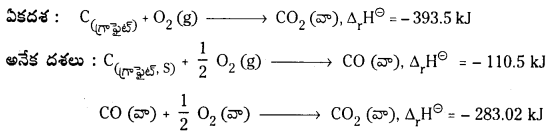
ఏకదశ : C(గ్రాఫైట్) + O2 (g) → CO2 (వా), Δr\(\mathrm{H}^{\ominus}\) = -393.5 kJ
అనేక దశలు : C(గ్రాఫైట్, S) + \(\frac{1}{2}\)O2 (g) → CO(వా), Δr\(\mathrm{H}^{\ominus}\) = -110.5 kJ
CO(వా) + \(\frac{1}{2}\) O2 (వా) → CO2 (వా), Δr\(\mathrm{H}^{\ominus}\) = -282.02 kJ
ఉదా : CO2 (వా) ను C (గ్రా), O2 (వా) నుండి రెండు విధాలుగా పొందవచ్చు.
అనేకదశలలో మొత్తం ఎంథాల్పీ మార్పు = – 392.52 కి.జౌ
ఏకదశలో మరియు అనేక దశలలో ఎంథాల్పీ మార్పు సమానంగా ఉంది కాబట్టి ఈ ఉదాహరణ హెస్ నియమానికి అనుగుణంగా ఉన్నది.
ఉపయోగాలు :
- ప్రయోగం ద్వారా నిర్ణయించడానికి వీలుకాని సమ్మేళనాల సంఘటనోష్టాలను ఈ నియమం ద్వారా పరోక్షంగా లెక్కించవచ్చు.
- నెమ్మదిగా జరిగే చర్యల చర్యోష్ణాన్ని నిర్ణయించవచ్చు.
- అయానిక పదార్థాల స్ఫటిక జాలకశక్తిని నిర్ణయించవచ్చు.
- కొన్ని మూలకాల ఎలక్ట్రాన్ ఎఫినిటి విలువలను పరోక్ష పద్ధతిలో కనుగొనవచ్చు.
ప్రశ్న 101.
ప్రయోగపూర్వకంగా ఒక ప్రక్రియలో అంతరిక శక్తి మార్పు కొలిచే విధానం వివరించండి.
జవాబు:
అంతరిక శక్తి : స్థిర ఉష్ణోగ్రత పీడనాల వద్ద ఒక పదార్థంలో నిల్వ ఉంచబడిన మొత్తం శక్తిని అంతరిక శక్తి అంటారు. ఇది స్థితి ప్రమేయం-మరియు విస్తార ధర్మం.
అంతరిక శక్తిలో మార్పు (ΔU) = Up – UR
U = క్రియాజన్యాల అంతరికశక్తి; Up – క్రియాజనకాల అంతరికశక్తి.
ΔU = Q – w;
Q = ఉష్ణం;
W = పని
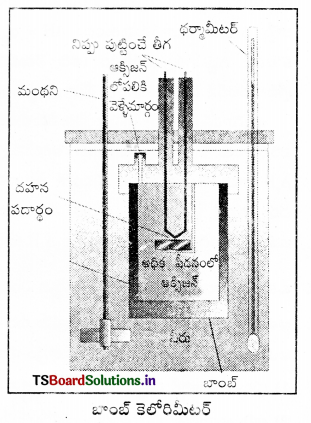
అంతరికశక్తి మార్పు ΔU కొలిచే సాధనం : రసాయన చర్యల్లో స్థిర ఘనపరిమాణం వద్ద గ్రహించబడిన ఉష్ణాన్ని బాంబ్ కెలోరిమీటర్లో కొలుస్తారు. బాంబ్ కెలోరిమీటర్ ఒక దృఢమైన గోడలు గల ఉక్కుపాత్ర. ఇది ఒక జల పతాకంలో ముంచబడి వుంటుంది. ఈ మొత్తం పాత్రల అమరికనే కెలోరిమీటర్ అంటారు. తేలికగా దహనం చెందే
పదార్థాన్ని ఉక్కు బాంబులో వుంచి ఆక్సిజన్ను కలిపి దహనం చేస్తారు. చర్య ఉష్ణమోచకమై ఉష్ణం వెలువడుతుంది. ఇది కెలోరిమీటర్ ఉష్ణోగ్రతను పెంచుతుంది. బాంబ్ కెల్ రెమీటర్ ఉష్ణబంధకం చేయబడి వుంటుంది. అందువల్ల కెలోరిమీటర్ నుంచి పరిసరాలకు ఉష్ణ వినిమయం జరగదు.
బాంబ్ కెలోరిమీటర్ చర్య జరిగేటపుడు పూర్తిగా మూసివుంచబడి వుంటుంది. కాబట్టి దాని ఘనపరిమాణంలో మార్పు ఉండదు. అంటే చర్యలో శక్తి మార్పులు స్థిర ఘనపరిమాణంలో జరిగిన వాటిగా అనుకొని కొలతలు చేయాలి. స్థిర ఘనపరిమాణం అంటే ΔU = 0, w = p ΔU = 0, అంటే చర్యలో పని ఏమీ జరగదు. చర్యలో వాయు పదార్థాలున్నప్పటికీ ఘనపరిమాణంలో మార్పురాదు. చర్య వల్ల కెలోరిమీటర్ పెరిగిన ఉష్ణోగ్రతను ఉపయోగించి కెలోరిమీటర్ ద్రవ్యరాశి, దాని ఉష్ణధారణ విలువల ద్వారా వెలువడిన ఉష్ణాన్ని (q1) క్రింది సమీకరణం ఉపయోగించి గణించవచ్చు.
విశిష్టోష్టణం × ద్రవ్యరాశి = ఉష్ణధారణ
q = C × m × ΔT = C × ΔT ఇచ్చట c × m = C
![]()
ప్రశ్న 102.
ప్రయోగ పూర్వకంగా ఒక ప్రక్రియలో ఎంథాల్పీ మార్పు కొలిచే విధానం వివరించండి.
జవాబు:
ఎంథాల్పీ (H) స్థిర పీడనం మరియు ఉష్ణోగ్రత వద్ద వ్యవస్థకు, పరిసరాలకు మధ్య మార్పిడి జరిగే ఉష్ణపరిమాణాన్ని ఎంథాల్పీ (H) అంటారు.
ఎంథాల్పీ మార్పు (ΔH) = ΔU + PΔU (లేక) ΔH + ΔnRT
ΔU = అంతరికశక్తి మార్పు,
P = పీడనం,
ΔV = ఘనపరిమాణంలో మార్పు.
ఎంథాల్పీ స్థితి ప్రమేయం మరియు విస్తార ధర్మం.
ఎంథాల్పీ మార్పు (ΔH) = Hక్రియాజన్యాలు – Hక్రియాజనకాలు
స్థిరపీడనం వద్ద ఉష్ణశక్తి ΔH ని కొలవడం : మూత లేకుండా తెరచి వున్న కెలోరిమీటర్ సాధారణంగా వాతావరణ పీడనం దగ్గర వుంటుంది. వాతావరణ పీడనం స్థిరంగా వుంటుంది కాబట్టి కెలోరిమీటర్లో చర్య వల్ల వచ్చిన ఉష్ణ మార్పు స్థిరపీడనం వద్ద కొలిచిందిగా భావించవచ్చు. దీనిని రాస్తే ΔH కు సమానమవుతుంది. ΔH = qp. కాబట్టి స్థిరపీడనం వద్ద కొలిచిన ఉష్ణమార్పు చర్యోష్ణం (అది వెలువడిన ఉష్ణం కావచ్చు లేదా గ్రహించబడిన ఉష్ణం కావచ్చు. లేదా చర్యా ఎంథాల్పి ΔrH అవుతుంది.
ఉష్ణమోచక చర్యలో ఉష్ణం వెలువడుతుంది. అంటే వ్యవస్థ నుంచి పరిసరాలకు ఉష్ణం ఇవ్వబడుతుంది. అందువల్ల qp రుణాత్మకమవుతుంది. ΔrH కూడా రుణాత్మకం. అదేవిధంగా ఉష్ణగ్రాహక చర్యలో వ్యవస్థ లేదా చర్య ఉష్ణం గ్రహిస్తుంది. అంటే పరిసరాల నుంచి చర్యకు ఉష్ణం ఇవ్వబడుతుంది. దీనికి qp ధనాత్మకం ΔrH కూడా ధనాత్మకమే.
ప్రశ్న 103.
ఒక చర్య అయత్నీకృతమా కాదా అన్నది ఎంథాల్పీ, ఎంట్రోపీ, గిబ్స్ శక్తులు ఉపయోగించి వివరించండి.
జవాబు:
అయత్నీకృత చర్య : బాహ్యకారకం ప్రమేయం లేకుండా స్వచ్ఛందంగా జరిగే చర్యను అయత్నీకృత చర్య అంటారు. అయత్నీకృత చర్యలు అన్నీ ఉష్ణగతిక శాస్త్రం ప్రకారం, “అద్విగత చర్యలే”.
- ప్రకృతిలో జరిగే చర్యలు అన్నీ అయత్నీకృత చర్యలే
- అన్ని అయత్నీకృత చర్యలలో ఎంట్రోపీలో పెరుగుదల ఉంటుంది.
- అయత్నీకృత చర్యలలో, ఎంథాల్పీ మార్పు (ΔS) = + ve
- అయత్నీకృత చర్యలలో, ఎంథాల్పీ మార్పు (ΔH) = – ve
- అయత్నీకృత చర్యల యొక్క నిబంధనను వివరించడానికి “గిబ్స్” ఒక ఉష్ణగతిక ప్రమేయాన్ని ప్రవేశపెట్టాడు. దానినే గిబ్స్ శక్తి అంటారు. ఈ గిబ్స్ శక్తికి, ఎంథాల్పీకి, ఎంట్రోపికి సంబంధం క్రింది విధంగా ఉంటుంది.
G = H – TS. దీనినే గిబ్స్ సమీకరణం అంటారు. అన్ని అయత్నీకృత చర్యలను
ΔG = – ve స్థిర ఉష్ణోగ్రత, మరియు పీడనం వద్ద జరిగే మార్పును గిబ్స్ సమీకరణాన్ని క్రింది విధంగా రాస్తారు.
ΔG = ΔH – TΔS
ΔS = + ve అయితే ప్రక్రియ అయత్నీకృతం
ΔS = – ve అయితే తిరోగామి చర్య అయత్నీకృతం
ΔS = 0, అయితే ప్రక్రియ సమతాస్థితితో ఉంటుంది.
అయత్నీకృత చర్యలు – నిబంధనలు :
చర్యల స్వచ్ఛందత లేదా అయత్నీకృతంపై ఉష్ణోగ్రత ప్రభావం