Here students can locate TS Inter 1st Year Chemistry Notes 4th Lesson పదార్ధం స్థితులు : వాయువులు, ద్రవాలు to prepare for their exam.
TS Inter 1st Year Chemistry Notes 4th Lesson పదార్ధం స్థితులు : వాయువులు, ద్రవాలు
→ ఒక పదార్థంలోని కణాలైన పరమాణువులు లేదా అణువుల మధ్య ఉండే ఆకర్షణ, వికర్షణ బలాలను అంతర అణుబలాలు అంటారు.
→ అంతర అణు ఆకర్షణ బలాలను వాండర్ వాల్స్ బలాలు అంటారు. అవి లండన్ విక్షేపణ బలాలు, ద్విధ్రువ ద్విధ్రువ బలాలు, ద్విధ్రువ – ప్రేరిత ద్విధ్రువ బలాలు. ఈ బలాలే కాక బలమైన ద్విధ్రువ-ద్విధృవ బలాలైన హైడ్రోజన్ బంధం.
→ పదార్థపు అణువుల ఉష్ణశక్తి, అంతర అణు బలాల మధ్యగల ఆధిక్యత పదార్థ భౌతిక స్థితుల మార్పుకు కారణమవుతుంది. ఉష్ణోగ్రతను తగ్గించినపుడు ఉష్ణశక్తి తగ్గి వాయువులు సులభంగా ద్రవీకరణం చెందుతాయి. వాయువులు అధికంగా సంపీడనం చెందుతాయి. వాయువులు ఘన, ద్రవపదార్థాల కంటే తక్కువ సాంద్రతను కలిగి ఉంటాయి.
→ వాయు ధర్మాలైన పీడనం, ఘనపరిమాణం, ఉష్ణోగ్రత, ద్రవ్యరాశిల మధ్య ఉండే సంబంధాలకు వాయు నియమాలు వర్తిస్తాయి.
→ స్థిర ఉష్ణోగ్రత వద్ద నియమిత ద్రవ్యరాశిగల వాయువు ఘనపరిమాణం దాని పీడనానికి విలోమానుపాతంలో ఉంటుంది. ఇది బాయిల్ నియమం.
→ స్థిర పీడనం వద్ద నిర్దిష్ట ద్రవ్యరాశి గల ఒక వాయువు 0°C వద్ద ఉండే ఘనపరిమాణం, ప్రతి 1°C ఉష్ణోగ్రత పెరుగుదలకు \(\frac{\mathrm{V}_0}{273.15}\) వంతున పెరుగుతుంది.
→ ఛార్లెస్ నియమం : స్థిరపీడనం వద్ద నియమిత ద్రవ్యరాశి గల వాయువు ఘనపరిమాణం పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.
→ అవొగాడ్రో నియమం : ఒకే ఉష్ణోగ్రత, పీడనాలలో సమాన ఘనపరిమాణాలున్న విభిన్న వాయువులు సమాన సంఖ్యలో అణువులను కలిగి ఉంటాయి.
→ ప్రమాణ ఉష్ణోగ్రతా పీడనాలు అంటే 273.15 K (0°C) ఉష్ణోగ్రత, 1 బార్ (10 Pa) పీడనం STP వద్ద ఒక ఆదర్శవాయువు మోలార్ ఘనపరిమాణం 22.71098L mol-1
![]()
→ బాయిల్, ఛార్లెస్, అవగాడ్రో నియమాలను కచ్చితంగా పాటించే వాయువును ఆదర్శవాయువు అంటారు.
→ ఆదర్శవాయు సమీకరణం PV = nRT
→ సంయుక్త వాయు సమీకరణం
→ R = 8,314 JK-1 mol-1
R = 0.08314 bar L K-1 mol-1
R = 8.314 JK-1 mol-1
→ 273.15K, ఒక అట్మాస్ఫియర్ పీడనం వద్ద R = 8.20578 × 10-2 L atm. K-1 mol-1
→ గ్రాహం నియమం : ఇచ్చిన పీడనం, ఉష్ణోగ్రతల వద్ద నియమిత ద్రవ్యరాశి గల వాయువు వ్యాపన రేటు దాని సాంద్రత యొక్క వర్గమూలానికి విలోమానుపాతంలో ఉంటుంది.
→ వాయు మిశ్రమం కలుగ చేసే పీడనం అందులోని ఘటక వాయువుల వ్యక్తిగత పీడనాల మొత్తానికి సమానం. రసాయనికంగా చర్య పొందని వాయు మిశ్రమాలకే ఇది వర్తిస్తుంది. దీనిని డాల్టన్ పాక్షిక పీడనాల నియమం అంటారు.
→ వాయు అణువులు పాత్ర గోడల పై కలుగచేసే తొడనాలే పీడనానికి కారణం.
→ వాయు అణువుల సగటు గతిజ శక్తి పరమ ఉష్ణోగ్రతకు అనులోమానుపాతంలో ఉంటుంది.
→ చలద్వాయు సమీకరణం PV = \(\frac{1}{3}\) mnurms2
→ వాయువుల గతిజశక్తి Ek = n.\(\frac{3}{2}\)RT; ఇచ్చట n = వాయుమోల్ల సంఖ్య
→ స్థిర ఉష్ణోగ్రత వద్ద P – V రేఖా పటాలను (isotherms) సమోష్ణోగ్రతా వక్రాలు అంటారు.
→ వాయువుల వేగాల నిష్పత్తి
Urms : Uav : Ump =1 : 1.128: 1.224
→ ఒక వాయు అణు స్థిరాంకం బోల్ట్మన్ స్థిరాంకం.
K = 1.38 × 10-16 erg K-1 molecule-1
K = 1.38 × 10-23 JK-1 molecule-1
→ బాయిల్ ఉష్ణోగ్రత : విస్తృత పీడనాల్లో ఏ ఉష్ణోగ్రత వద్దనైతే నిజవాయువు ఆదర్శవాయు నియమాన్ని పాటిస్తుందో ఆ ఉష్ణోగ్రతను బాయిల్ ఉష్ణోగ్రత అంటారు.
→ అధిక పీడనాలు, అల్ప ఉష్ణోగ్రతల వద్ద వాయువులు ఆదర్శ ప్రవర్తన నుండి విచలనాన్ని చూపుతాయి.
→ సంపీడ్యతా గుణకం Z = \(\frac{\mathrm{PV}}{\mathrm{nRT}}\) లేదా
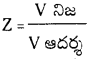
→ ఏ ఉష్ణోగ్రత కన్నా అధిక ఉష్ణోగ్రత వద్ద అధిక పీడనాన్ని ఉపయోగించినప్పటికీ, వాయువులను ద్రవీకరింప- చేయలేమో ఆ ఉష్ణోగ్రతను సందిగ్ధ ఉష్ణోగ్రత అంటారు. CO2 సందిగ్ధ ఉష్ణోగ్రత 30.98°C
→ సందిగ్ధ ఉష్ణోగ్రత ఎక్కువగా ఉండే వాయువులలో అంతర అణు ఆకర్షణ బలాలు అధికం. అటువంటి వాటిని సులభంగా ద్రవీకరణం చెందించవచ్చు.
→ 1 బార్ పీడనం వద్ద ద్రవం మరిగే ఉష్ణోగ్రతను ప్రమాణ బాష్పీభవన స్థానం అంటారు.
![]()
→ సాధారణంగా ద్రవం ప్రమాణ బాష్పీభవన స్థానం, సాధారణ బాష్పీభవన స్థానం కంటే కొంచెం తక్కువ. దీనికి కారణం 1 బార్ పీడనం, 1 అట్మాస్ఫియర్ కంటే తక్కువ కావటమే.
→ ద్రవం ఉపరితలంపై గీసిన రేఖకు లంబ దిశలో ఏకాంక పొడవుపై పనిచేసే బలాన్ని తలతన్యత అంటారు. SI ప్రమాణాలు Nm-1
→ ఏకాంక స్పర్శా వైశాల్యం, ఏకాంక వేగ ప్రవీణత గల ద్రవ ప్రవాహపు పొరపై పనిచేసే బలాన్ని స్నిగ్ధతా గుణకం అంటారు.