Here students can locate TS Inter 1st Year Chemistry Notes 5th Lesson స్టాయికియోమెట్రీ to prepare for their exam.
TS Inter 1st Year Chemistry Notes 5th Lesson స్టాయికియోమెట్రీ
→ ద్రవ్యనిత్యత్వ నియమం : ఒక రసాయన చర్యలో పదార్థాన్ని కొత్తగా ఏర్పరచడంగానీ, నాశనం చేయడంగానీ జరగదు.
→ స్థిరానుపాత నియమం : ఒక నిర్దిష్ట సంయోగ పదార్థంలో ఒకే మూలకాలు స్థిరభార నిష్పత్తిలో కలిసి ఉంటాయి.
→ బహ్వానుపాత నియమం : రెండు మూలకాలు రసాయనికంగా సంయోగం చెంది రెండు లేదా అంతకన్నా ఎక్కువ సమ్మేళనాలను ఏర్పరిస్తే వాటిల్లో స్థిర భారం గల మూలకంతో కలిసే రెండవ మూలకం భారాలు సరళ పూర్ణ నిష్పత్తిలో ఉంటాయి.
→ అవగాడ్రో సంఖ్య : ఒక గ్రాము పరమాణు భారం గల పదార్థంలో ఎన్ని పరమాణువులు ఉంటాయో దానినే అవగాడ్రో సంఖ్య అంటారు. దీని విలువ 6.023 × 1023
→ తుల్యాంక భారం : భారాత్మకంగా 1 భాగం హైడ్రోజన్తో లేక 8 భాగాలు ఆక్సిజన్ లేక 35.5 భాగాల క్లోరిన్తో సంయోగం చెందే (లేక) తొలగించే మూలకపు భారభాగాల సంఖ్యను ఆ మూలకం తుల్యభారం అంటారు.
→ స్థాయికియోమెట్రీ: రసాయన చర్యలలో క్రియాజనకాలు, క్రియాజన్యాల మధ్య గల పరిమాణాత్మక సంబంధాన్ని స్టాయికియోమెట్రీ అంటారు.
→ రిడాక్స్ చర్యలు : ఏ రసాయన చర్యలలో ఆక్సీకరణం మరియు క్షయకరణం రెండూ జరుగుతాయో అట్టి చర్యలను రిడాక్స్ చర్యలు అంటారు.
![]()
→ రిడాక్స్ చర్యలలో రకాలు : ఇవి 5 రకాలు
- సంయోగ చర్యలు
- వియోగ చర్యలు
- స్థానభ్రంశ చర్యలు
- అననుపాత చర్యలు
- సహానుపాత చర్యలు,
→ సాపేక్ష పరమాణు ద్రవ్యరాశులను నిర్ణయించడానికి C – 12 ను ప్రమాణంగా తీసుకుంటారు.
→ C -12 ద్రవ్యరాశిలో \(\frac{1}{12}\)వ వంతు ద్రవ్యరాశిని పరమాణు ద్రవ్యరాశి ప్రమాణం (a.mu.) అంటారు.
→ am.u. విలువ 1.66 × 10-24 gms. దీనిని ఆవోగ్రామ్ అంటారు.
→ అణుభారం విలువను గ్రామ్లలో తెలియజేస్తే దానిని గ్రామ్ అణుభారం (లేక) గ్రామ్ మోల్ అంటారు.
→ ఒక గ్రామ్ అణుభారం పదార్థంలో ఉన్న పరమాణువుల లేక అణువుల సంఖ్యను అవగాడ్రో సంఖ్య అంటారు. దీనిని N తో సూచిస్తారు. దీని విలువ 6.023 × 1023.
→ ఒక గ్రామ్ అణుభారం గల వాయువు STP వద్ద ఆక్రమించే ఘనపరిమాణాన్ని గ్రామ్ మోలార్ ఘ.ప. అంటారు. దీని విలువ 22.4 లీటర్లు (లేక) 22,400 CC. దీనిని GMV తో సూచిస్తారు.
→ S.I. యూనిట్లలో ఒక పదార్థం యొక్క ద్రవ్యరాశిని మోల్లో వ్యక్తపరుస్తారు.
→ అవగాడ్రో సంఖ్య పరమాణువులు లేక అణువులు లేక అయాన్లు ఎంత పదార్థంలో ఉంటాయో దానినే మోల్ అంటారు.
→ సంయోగస్థితిలో ఉన్న పరమాణువు ప్రదర్శించే దృశ్య ఆవేశాన్ని ఆ పరమాణువు యొక్క ఆక్సీకరణ సంఖ్య అంటారు. ఆక్సీకరణ సంఖ్య ధనాత్మకం (లేక) ఋణాత్మకం (లేక) భిన్నాంకంగా ఉండవచ్చు.
→ ఫ్లోరిన్ ఎల్లపుడు ఋణ ఆక్సీకరణ స్థితి విలువను మాత్రమే ప్రదర్శిస్తుంది.
→ ఏ చర్యలో ఎలక్ట్రాన్లు తీసివేయబడతాయో దానిని ఆక్సీకరణ చర్య అంటారు.
→ ఏ చర్యలో ఎలక్ట్రాన్లు గ్రహింపబడతాయో దానిని క్షయకరణ చర్య అంటారు. * ఎలక్ట్రాన్లను గ్రహించే పదార్థాన్ని ఆక్సీకరణి అంటారు.
→ ఎలక్ట్రాన్లను పోగొట్టుకునే పదార్థాన్ని క్షయకరణి అంటారు.
→ ఏ రసాయన చర్యలో ఆక్సీకరణం మరియు క్షయకరణం జరుగుతాయో అట్టి చర్యను రిడాక్స్ చర్య అంటారు.
→ రిడాక్స్ చర్యలను
(a) అయాన్ ఎలక్ట్రాన్ పద్ధతి ద్వారా
(b) ఆక్సీకరణ సంఖ్య పద్ధతి ద్వారా తుల్యం చేస్తారు.
![]()
→ తుల్యం చేయబడిన రసాయన చర్య ద్వారా తెలియజేయబడే పదార్థాల ద్రవ్యరాశుల సాపేక్ష నిష్పత్తిని స్థాయికియోమెట్రీ అంటారు.
→ ఒక మూలకం యొక్క భారానికి ఆ మూలకం కలిగి ఉన్న సమ్మేళనం యొక్క భారానికి గల భార నిష్పత్తికి 100 రెట్లును ఆ మూలకం యొక్క సంఘటన శాతం అంటారు.
→ ఒక అణువు పదార్థంలోని అంతర్గత మూలకాల పరమాణువులు సరళ నిష్పత్తిని తెలియజేసే ఫార్ములాను అనుభావిక ఫార్ములా అంటారు.
→ ఒక అణువు పదార్థంలోని అంతర్గత మూలకాల ఖచ్చితమైన పరమాణువుల సంఖ్యను తెలియజేసే ఫార్ములాను అణు ఫార్ములా అంటారు.
→ అణుఫార్ములా = అనుభావిక ఫార్ములా xn
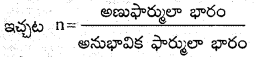
→ ఆక్సీకరణ సంఖ్యలో పెరుగుదలను ప్రదర్శించే చర్యను ఆక్సీకరణ చర్య అని, ఆక్సీకరణ సంఖ్యలో తగ్గుదలను ప్రదర్శించే చర్యను క్షయకరణ చర్య అని అంటారు.