Telangana TSBIE TS Inter 1st Year Chemistry Study Material 13th Lesson కర్బన రసాయన శాస్త్రం – సామాన్య సూత్రాలు, విధానాలు Textbook Questions and Answers.
TS Inter 1st Year Chemistry Study Material 13th Lesson కర్బన రసాయన శాస్త్రం – సామాన్య సూత్రాలు, విధానాలు
అత్యంత లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 1.
బెంజీన్ న్ను మీథైల్ బెంజీన్ గా మార్చడానికి అవసరమైన కారకాలు రాయండి.
జవాబు:
AlCl3 ఉత్ప్రేరకం సమక్షంలో బెంజీన్, మిథైల్ క్లోరైడ్ చర్య జరిపితే మిథైల్ బెంజీన్ ఏర్పడుతుంది.
![]()
ప్రశ్న 2.
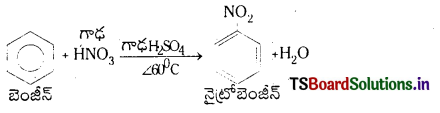
నైట్రో బెంజీన్ను ఎలా తయారుచేస్తారు?
జవాబు:
బెంజీన్ ను 60°C కంటే తక్కువ ఉష్ణోగ్రత వద్ద గాఢ HNO3 మరియు గాఢ H2SO4 ల మిశ్రమంతో వేడిచేస్తే నైట్రోబెంజీన్ ఏర్పడుతుంది.
![]()
ప్రశ్న 3.
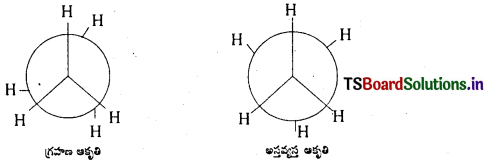
ఈథేన్ అనురూపకాలను రాయండి.
జవాబు:
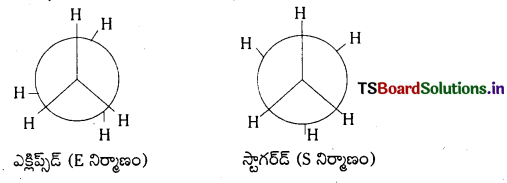
ఈథేన్ – అనురూపాత్మక సాదృశ్యములు : ఈథేన్ అణువులో ఒక కార్బన్ పరమాణువు స్థానమును స్థిరీకరించి రెండవ కార్బన్ పరమాణువును C – C బంధ అక్షముపై చక్ర భ్రమణము చేయుట వలన అనేక ప్రాదేశిక అమరికలు గల రూపములు లభించును. ఈ రూపములను అనురూపాత్మక సాదృశ్యములందురు. ఈథేన్ ప్రధాన అనురూపాత్మక సాదృశ్యములు.
- గ్రహణ ఆకృతి
- అస్తవ్యస్త ఆకృతి
ప్రశ్న 4.
ఇథిలీన్ నుంచి ఈథైల్ క్లోరైడ్ను ఎలా తయారుచేస్తారు?
జవాబు:
ఇథిలీన్ ను HCl తో చర్య జరిపి ఈథైల్ క్లోరైడ్ను తయారు చేస్తారు.
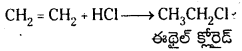
ప్రశ్న 5.
కింది నిర్మాణాల IUPAC నామాలు రాయండి.
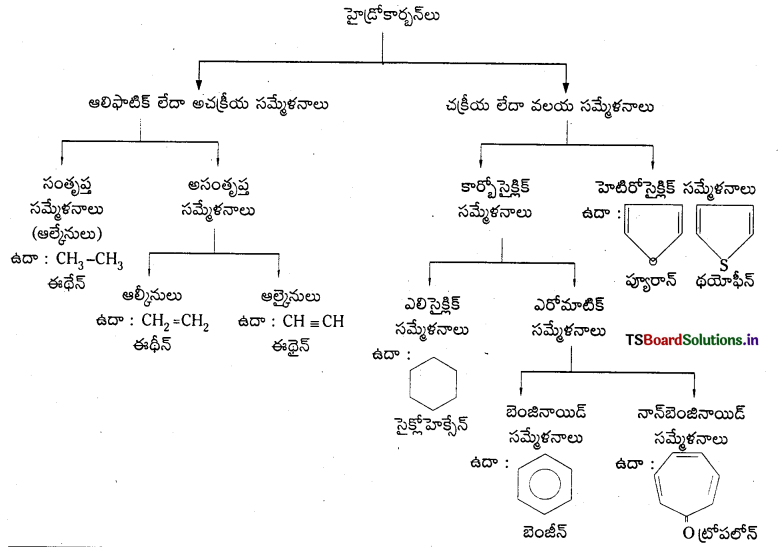
(a) CH3-CH2-CH2-CH=CH2
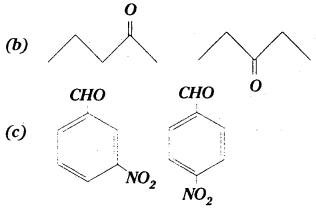
జవాబు:
(a) 1-పెంటీన్
(b) పెంటేన్-2-ఓన్, పెంటేన్-3-ఓన్
(c) 3-నైట్రో బెంజాల్డిహైడ్, 4-నైట్రో బెంజాల్డిహైడ్
ప్రశ్న 6.
కింది వాటి నిర్మాణాలను రాయండి.
(i) ట్రైక్లోరో ఇథనాయిక్ ఆమ్లం
(ii) నియోపెంటేన్
(iii) P-నైట్రో బెంజాల్డిహైడ్ (March 2013)
జవాబు:
(i) ట్రైక్లోరో ఇథనాయిక్ ఆమ్లం – CCl3COOH
(ii) నియోపెంటేన్ 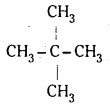
(iii) P-నైట్రో బెంజాల్డిహైడ్
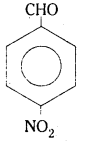
![]()
ప్రశ్న 7.
లాసజీన్ చర్యను వివరించండి.
జవాబు:
లాసజీన్ చర్య : పొడిగా ఉన్న చిన్న Na లోహాన్ని గలన స్థితిలో మారే వరకు గలన నాళికలో వేడి చేయవలెను. ఈ గలన Naకు కర్బన సమ్మేళనం కలిపి ఎర్రగా మారేవరకు వేడి చేయవలెను. చైనా పాత్రలో ఈ ఎర్రగా కాలిన నాళికను వేసి నీటిని కలిపి మరిగించి చల్లబరచి వడపోయవలెను. ఈ వడపోత ద్రావణాన్ని లాసైన్ కషాయం అంటారు. ఈ పరీక్ష N, S, హాలోజన్లను గుర్తించుటకు ఉపయోగపడును.
నైట్రోజన్ను గుర్తించుట : కొద్దిగా లెసైన్ ద్రావణాన్ని పరీక్ష నాళికలో తీసుకొని దానికి కొన్ని చుక్కలు NaOH ద్రావణం కలిపి క్షారీకృతం చేసి దానికి అపుడే తయారు చేసిన ఫెర్రస్ సల్ఫేట్ ద్రావణాన్ని కలుపుతారు. దీనికి 2 లేక 3 చుక్కలు FeCl3 ద్రావణం కలిపి చల్లబరిచి గాఢ HCl ద్రావణంతో ఆమ్లీకృతం చేస్తారు. ప్రశ్యన్ బ్లూ రంగు ఏర్పడుతుంది.
ప్రశ్న 8.
క్రోమటోగ్రఫీ సిద్ధాంతాన్ని వివరించండి.
జవాబు:
క్రోమటోగ్రఫీని మిశ్రమ పదార్థాలను వేరు చేయడానికి, కర్బన పదార్థాలను శుద్ధి చేయడానికి, పదార్థాల పరిశుద్ధతను పరిశీలించడానికి ఉపయోగిస్తారు. ఈ పద్ధతిలో పదార్థాల మిశ్రమాన్ని ఒక స్థిర ప్రావస్థ మీద అధిశోషణం చేస్తారు. స్థిర ప్రావస్థగా ఘనపదార్థం కానీ ద్రవపదార్థం కానీ ఉండవచ్చు. స్వచ్ఛమైన ద్రావణి కానీ ద్రావణాల మిశ్రమం కానీ లేదా వాయువును కానీ స్థిరప్రావస్థ మీదకి మెల్లగా పంపిస్తారు. మిశ్రమంలోని పదార్థాలు క్రమంగా ఒకదాని నుంచి మరొకటి వేరు పడతాయి.
ప్రశ్న 9.
జలబాష్ప స్వేదనంలో కర్బన ద్రవం దాని బాష్పీభవన స్థానం కంటే తక్కువ ఉష్ణోగ్రత వద్ద ఎందుకు ఆవిరిగా మారుతుంది?
జవాబు:
జలబాష్ప స్వేదనంలో కర్బన ద్రవం బాష్పపీడనం P1 నీటి ఆవిరి పీడనం P2ల మొత్తం బాహ్య వాతావరణ పీడనం P కి సమానం అయినప్పుడు ద్రవం మరుగుతుంది. అంటే P = P1 + P2. కర్బన ద్రవ బాష్ప పీడనం P1, P కంటే తక్కువ కాబట్టి అది దాని బాష్ప పీడన స్థానం కంటే తక్కువ ఉష్ణోగ్రత వద్ద బాష్పీకరణం చెందుతుంది.
ప్రశ్న 10.
కింది వాటిని వివరించండి.
(a) స్ఫటికీకరణం
(b) స్వేదనం
జవాబు:
(a) స్ఫటికీకరణం : మలిన పదార్థాన్ని అది కరిగే ద్రావణిలో దాని బాష్పీభవన స్థానం దగ్గర కరిగించి, మరిగించి సంతృప్త ద్రావణాన్ని తయారుచేసి ఆ గాఢ ద్రావణాన్ని చల్లార్చి పరిశుద్ధమైన సమ్మేళనాన్ని దాని స్ఫటిక రూపంలో పొందే ప్రక్రియను స్ఫటికీకరణం అంటారు.
ఈ పద్ధతిని ఘన సమ్మేళనాలను శుద్ధి చేయడానికి ఉపయోగిస్తారు. ఇవ్వబడిన మలిన ఘన సమ్మేళనాన్ని అది కరిగే ద్రావణిలో దాని బాష్పీభవన స్థానం దగ్గర కరిగించి దాదాపు సంతృప్త ద్రావణం వచ్చే వరకు మరిగించి వడపోయాలి. ద్రావణాన్ని నెమ్మదిగా చల్లారిస్తే పరిశుద్ధ సమ్మేళనం స్ఫటికాల రూపంలో బయటకు వస్తుంది. కరిగిన మలినాలు ద్రావణంలో మిగిలిపోతాయి.
(b) స్వేదనం : ఈ పద్ధతి
- బాష్పశీల ద్రవాల నుంచి అబాష్పశీల మలినాలను వేరుచేయడానికి
- బాష్పీభవన స్థానాలలో సరిపడ తేడా ఉన్న ద్రవాల మిశ్రమాన్ని వేరు చేయడానికి ఉపయోగిస్తారు.
విభిన్న బాష్పీభవన స్థానాలు ఉన్న ద్రవాలు వేరువేరు ఉష్ణోగ్రతల వద్ద పూర్తిగా బాష్పాలుగా మారతాయి. ఈ బాష్పాలను చల్లబరిస్తే ఏర్పడే ద్రవాలను వేరుగా సంగ్రహించవచ్చు.
ఉదా : క్లోరోఫారం (ద్ర.స్థానం 334 K) మరియు ఎనిలీన్ (ద్ర. స్థానం 457 K) మిశ్రమాన్ని స్వేదన పద్ధతిలో వేరుచేస్తారు.
లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 11.
కింది చర్యలను పూరించి A, B, C ఉత్పన్నాల నామాలు రాయండి.
![]()
జవాబు:
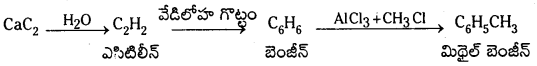
A – ఎసిటిలీన్
B – బెంజీన్
C – మిథైల్ బెంజీన్
![]()
ప్రశ్న 12.
కింది చర్యలో ఏర్పడిన A, B, C ఉత్పన్నాల పేర్లను రాసి, చర్యా సమీకరణాన్ని రాయండి.
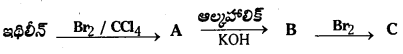
జవాబు:
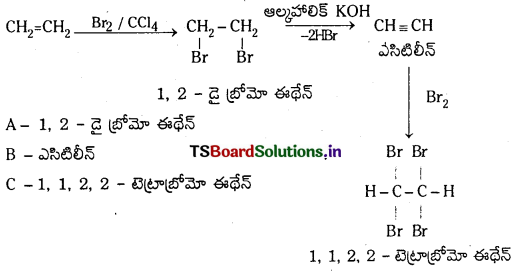
ప్రశ్న 13.
ఎసిటిలీన్ a) బ్రోమిన్ b) హైడ్రోజన్తో ఎట్లా చర్య జరుపుతుంది? పై చర్యలకు సమీకరణాలు రాసి ఉత్పన్నాల పేర్లను తెలపండి.
జవాబు:
a) ఎసిటిలీన్ CCl4 సమక్షంలో బ్రోమిన్తో చర్య జరిపి 1, 1, 2, 2 – టెట్రా బ్రోమో ఈథేన న్ను ఏర్పరుస్తుంది.
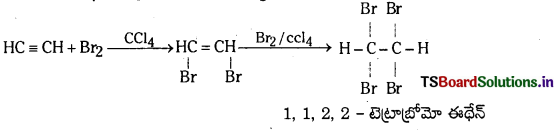
b) ఎసిటిలీన్ Ni లేదా Pt ఉత్ప్రేరకం సమక్షంలో హైడ్రోజన్తో చర్య జరిపి ఈథేన్ ను ఏర్పరుచును.
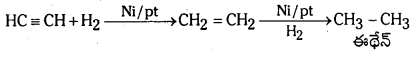
ప్రశ్న 14.
ప్రతిక్షేపణ చర్య అంటే ఏమిటి? ఏవైనా రెండు బెంజీన్ ప్రతిక్షేపక చర్యలను తెలపండి.
జవాబు:
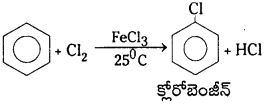
కర్బన సమ్మేళనంలోని ఏదేని పరమాణువు లేక పరమాణువుల సమూహాన్ని వేరొక పరమాణువు లేదా పరమాణువుల సమూహంతో ప్రతిక్షేపించుటను ప్రతిక్షేపణ చర్య అంటారు. బెంజీన్ ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్యలు జరుపుకుంటుంది. బెంజీన్ యొక్క ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్యలు :
1. హాలోజనీకరణం : బెంజీన్ను FeCl3 సమక్షంలో క్లోరిన్హో చర్య జరపగా క్లోరో బెంజీన్ ఏర్పడుతుంది.
2. నైట్రోకరణం : బెంజీన్ను నైట్రేషన్ మిశ్రమంతో (గాఢ HNO3 + గాఢ H2SO4) 60°C కన్నా తక్కువ ఉష్ణోగ్రత వద్ద చర్య జరుపగా నైట్రో బెంజీన్ ఏర్పడుతుంది.
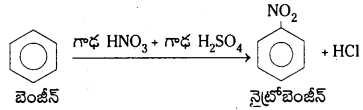
![]()
ప్రశ్న 15.
డీహైడ్రోహాలోజినేషన్ చర్య అంటే ఏమిటి? ఆల్కైల్ హాలైడ్ నుంచి ఆల్కీన్ ఏర్పడే చర్యను రాయండి.
జవాబు:
డీహైడ్రోహాలోజనీకరణం : ఒక సమ్మేళనంలోని ప్రక్క ప్రక్కన గల కార్బన్ పరమాణువుల నుండి హైడ్రోజన్ మరియు హాలోజన్ పరమాణువులను హైడ్రోజన్ హాలైడ్ అణువుగా తొలగించు చర్యను డీహైడ్రోహాలోజనీకరణం అంటారు.
ఆల్కైల్ హాలైడ్ను ఆల్కహాలిక్ KOH తో వేడిచేయగా డీహైడ్రో హాలోజనీకరణం చెంది ఆల్కీన్ (ఇథిలీన్) ఏర్పడుతుంది.
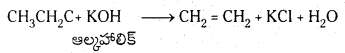
ప్రశ్న 16.
ఓజోన్తో ఎటువంటి సమ్మేళనాలు చర్యనొందుతాయి? ఏదైనా ఒక ఉదాహరణతో వివరించండి.
జవాబు:
అసంతృప్త హైడ్రోకార్బన్లు ఓజోన్లో చర్య జరుపుతాయి.
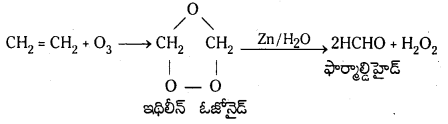
ఇథిలీన్, ఎసిటిలీన్, బెంజీన్ మొదలగునవి. ఓజోన్ తో చర్య జరిపి అస్థిరమైన ఓజనైడ్లను ఏర్పరుస్తాయి. ఇవి జల విశ్లేషణ చెంది కార్బొనైల్ సమ్మేళనాలను ఏర్పరుస్తాయి. ఈ చర్యను ఓజోనీకరణం అంటారు.
ఉదా : ఇథిలీన్, ఓజోన్తో చర్య జరిపి అస్థిర ఇథిలీన్ ఓజ నైడ్ను ఏర్పరుస్తుంది. ఇది జలవిశ్లేషణ చెంది ఫార్మాల్డిహైడ్ ఏర్పడుతుంది.
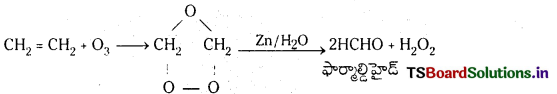
ప్రశ్న 17.
స్థాన సాదృశ్యానికీ, ప్రమేయ సాదృశ్యానికీ క్రమంగా రెండు ఉదాహరణలు ఇవ్వండి. (March 2013)
జవాబు:
1) కర్బన శృంఖలంపై ఉన్న ప్రతిక్షేపకం లేదా ప్రమేయ సమూహ స్థానాల్లో భేదం వలన ఏర్పడే సాదృశ్యాన్ని స్థాన సాదృశ్యం అంటారు.
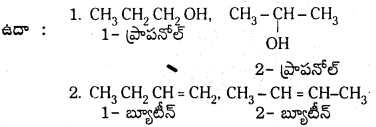
2) అణు సంకేతం ఒకటే ఉండి ప్రమేయ సమూహాలు వేరుగా ఉండటం వలన ఏర్పడిన సాదృశ్యాన్ని ప్రమేయ సమూహ సాదృశ్యం అంటారు.
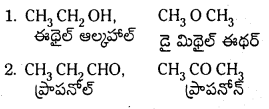
ప్రశ్న 18.
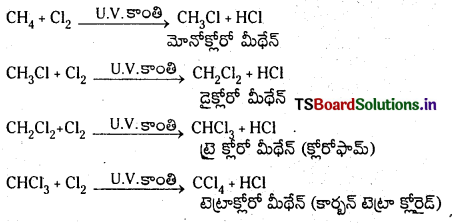
మీథేన్ హాలోజనీకరణం చర్యాగతిని రాయండి.
జవాబు:
మీథేన్ హాలోజనీకరణం : సూర్యరశ్మి లేదా U.V కాంతి సమక్షంలో మీథేన్ హాలోజన్లతో చర్య జరుపుతుంది. ఈ చర్యలో మీథేన్లోని H పరమాణువులు హాలోజన్ పరమాణువులతో ప్రతిక్షేపక చర్య జరిపి మోనో, డై, ట్రై మరియు టెట్రాహలో మీథేన్లు వరసగా ఏర్పడతాయి.
![]()
ప్రశ్న 19.
ఈథైల్ ఆల్కహాల్ నుంచి ఇథిలీన్ న్ను ఎట్లా తయారుచేస్తారు?
జవాబు:
ఈథైల్ ఆల్కహాల్ నుండి ఇథిలీన్ ను తయారు చేయుట :
ఈథైల్ ఆల్కహాల్ నిర్జలీకరణ : ఈథైల్ ఆల్కహాల్ను గాఢ H2SO4 తో కలిపి 170°C వద్ద వేడిచేస్తే ఇథిలీన్ ఏర్పడుతుంది.
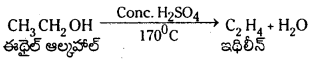
ప్రశ్న 20.
కింది వాటితో ఎసిటిలీన్ చర్యలను వివరించండి.
(a) Na/NH3
(b) క్రోమిక్ ఆమ్లం సమీకరణాలను, ఉత్పన్నాల పేర్లను రాయండి
జవాబు:
a) ఎసిటిలీన్ సోడియం లోహంతో చర్య జరిపి మోనోసోడియమ్ ఈథనైడ్ మరియు డై సోడియం ఈథనైడు ఏర్పరుస్తుంది.
ఈ చర్య ఎసిటిలీన్ యొక్క ఆమ్ల ధర్మాన్ని వివరిస్తుంది.
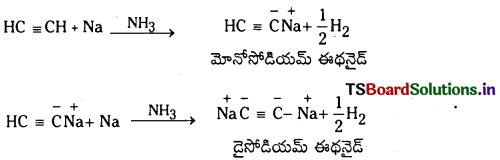
b) ఎసిటిలీన్ను క్రోమిక్ ఆమ్లం ఎసిటిక్ ఆమ్లంగా ఆక్సీకరణం చేస్తుంది.
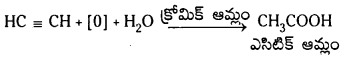
ప్రశ్న 21.
కర్బన ద్రవాలను శుద్ధి చేసే ప్రక్రియలు – స్ఫటికీకరణం, ఉత్పతనాలను వివరించండి.
జవాబు:
స్ఫటికీకరణం : మలిన పదార్థాన్ని అది కరిగే ద్రావణిలో దాని బాష్పీభవన స్థానం దగ్గర కరిగించి మరిగించి సంతృప్త ద్రావణాన్ని తయారుచేసి ఆ గాఢ ద్రావణాన్ని చల్లార్చి పరిశుద్ధమైన సమ్మేళనాన్ని దాని స్ఫటిక రూపంలో పొందే ప్రక్రియను స్ఫటికీకరణం అంటారు.
ఈ పద్ధతిని ఘన సమ్మేళనాలను శుద్ధి చేయడానికి ఉపయోగిస్తారు. ఇవ్వబడిన మలిన ఘన సమ్మేళనాన్ని అది కరిగే ద్రావణిలో దాని బాష్పీభవన స్థానం దగ్గర కరిగించి దాదాపు సంతృప్త ద్రావణం వచ్చే వరకు మరిగించి వడపోయాలి. ద్రావణాన్ని నెమ్మదిగా చల్లారిస్తే పరిశుద్ధ సమ్మేళనం స్ఫటికాల రూపంలో బయటకు వస్తుంది. కరిగిన మలినాలు ద్రావణంలో మిగిలిపోతాయి.
ఉత్పతనం : కొన్ని ఘనపదార్థాలను వేడిచేస్తే అవి ద్రవస్థితికి రాకుండా నేరుగా బాష్పస్థితికి చేరుకుంటాయి. మరల ఆ బాష్పాలను చల్లారిస్తే ద్రవస్థితిని పొందకుండా నేరుగా ఘనస్థితిని పొందుతాయి. దీనినే ఉత్పతనం అంటారు.
ఉదా : అపరిశుద్ధ సమ్మేళనాన్ని ఒక వాచ్ గ్లాసుతో మూసి ఉన్న బీకరులో తీసుకొని ఒక ఎలక్ట్రిక్ ప్లేటు మీద పెట్టి వేడిచేస్తారు. సమ్మేళనం ఉత్పతనం చెంది వాచ్స్ అడుగుభాగాన ఘనరూపంలో చేరుకుంటుంది. మలినాలు బీరలోనే ఉండిపోతాయి.
ప్రశ్న 22.
సమ్మేళనాన్ని శుద్ధిచేసే ద్రావణ నిష్కర్షణాన్ని తెలపండి.
జవాబు:
ద్రావణ నిష్కర్షణ : ఒక కర్బన పదార్థం ‘X’ నీటిలో కరగని కర్బన ద్రావణిలో, నీటిలో కంటే అధికంగా కరుగుతుంది.
కాని నీటిలో కరిగి ఉన్న ఆ పదార్థపు జల ద్రావణాన్ని కర్బన ద్రావణిలో కలిపి కుదిపితే ‘X’ కర్బన ద్రావణిలోకి అధికంగా వెళ్ళిపోతుంది. కర్బన ద్రావణాన్ని వేరు చేసి స్వేదనం చేస్తే కర్బన ద్రావణి బాష్పరూపంలో కర్బన సమ్మేళనం నుంచి వేరవుతుంది. సమ్మేళనం స్వేదన కుప్పెలో ఉంటుంది.
ప్రశ్న 23.
కర్బన సమ్మేళనంలోని ఫాస్ఫరస్, సల్ఫర్ల భారశాతాన్ని కనుక్కొనే విధానాలను తెలపండి.
జవాబు:
కర్బన సమ్మేళనంలోని ఫాస్ఫరస్ భారశాతం కనుక్కొనుట : ఫాస్ఫరస్ భారశాతాన్ని కనుక్కోవడానికి తెలిసిన ద్రవ్యరాశి గల కర్బన పదార్థాన్ని సధూమ నైట్రికామ్లంలో వేడి చేయాలి. ఫాస్ఫరస్ ఫాస్ఫారిక్ ఆమ్లంగా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లానికి అమ్మోనియా, అమ్మోనియం మోలిబేట్ ద్రావణాలు కలిపి అమ్మోనియం ఫాస్ఫో మోలిబేట్ [(NH4)3 PO4.12M0O3]గా అవక్షేపించాలి.
కర్బన సమ్మేళనం ద్రవ్యరాశి = mg
అమ్మోనియం ఫాస్ఫోమోలిబేడ్ = m1g
(NH4)33PO4 . 12 MoO3 అణు ద్రవ్యరాశి = 1877g
ఫాస్ఫరస్ భారశాతం = \(\frac{31 \times \mathrm{m}_1 \times 100}{1877 \times \mathrm{m}}\)
కర్బన సమ్మేళనంలోని సల్ఫర్ భారశాతం కనుక్కొనుట : కర్బన సమ్మేళనంలోని సల్ఫర్ భారశాతం కనుక్కోవడానికి తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని సోడియం పెరాక్సైడ్ లేదా సధూమ నైట్రికామ్లంతో కేరియస్ నాళికలో వేడిచేస్తారు. సమ్మేళనంలోని సల్ఫర్ H2SO4 గా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లానికి అధికంగా జల బేరియం క్లోరైడ్ ద్రావణం కలిపి బేరియం సల్ఫేట్గా అవక్షేపింప చేస్తారు. ఈ అవక్షేపాన్ని వడపోత ద్వారా వేరుచేసి, కడిగి, పొడి చేసి భారాన్ని కనుక్కొంటారు.
తీసుకున్న కర్బన పదార్ధ భారం = mg
ఏర్పడిన బేరియం సల్ఫేట్ భారం = m1g
m1, gల బేరియం సల్ఫేట్లోని సల్ఫర్ = \(\frac{32 \times m_1}{233} \mathrm{~g}\)
(1 మోల్ BaSO4 = 233 gm BaSO4 = 32 gm సల్ఫర్)
సల్ఫర్ భారశాతం = \(\frac{32 \times \mathrm{m}_1 \times 100}{233 \times \mathrm{m}}\)
![]()
ప్రశ్న 24.
ప్రోపీన్ HBr సంకలన చర్యను అయానిక చర్యాగతితో వివరించండి.
జవాబు:
ప్రోపీన్తో HBr సంకలనం చెంది మార్కొనికాఫ్ నియమము ప్రకారం 2-బ్రోమో ప్రోపెన్ను ఇస్తుంది. కాని బెంజాయిల్ పెరాక్సైడ్ సమక్షంలో ప్రోపీను HBrను కలిపితే 1-బ్రోమో ప్రోపేను ఏర్పడుతుంది. ఇక్కడ యాంటి మార్కొనికాఫ్ నియమము ప్రకారము సంకలనం జరుగుతుంది.
మార్కొనికాఫ్ నియమము : ఒక అసమకారకం ద్విబంధంలో సంకలనం చెందేటపుడు అసమకారకం రుణావేశ భాగం ద్విబంధంలో తక్కువ హైడ్రోజన్లున్న కార్బన్పై సంకలనం చెందుతుంది.
చర్యావిధానము (ఎలక్ట్రోఫిల్లిక్ సంకలన చర్య) :
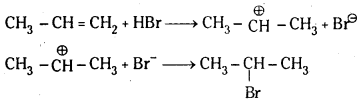
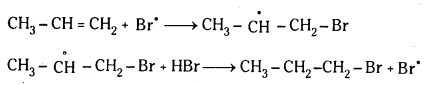
యాంటి మార్కొనికాఫ్ నియమము : ఒక అసమకారకం ద్విబంధంతో పెరాక్సైడ్ల సమక్షంలో సంకలనం చెందేటపుడు అసమకారకం రుణావేశ భాగం ద్విబంధంలో ఎక్కువ హైడ్రోజన్లున్న కార్బన్పై సంకలనం చెందుతుంది. దీనినే ఖరాష్ ప్రభావం అని కూడా అంటారు.
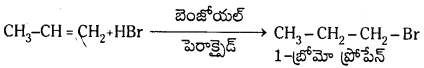
చర్యావిధానం (స్వేచ్ఛా ప్రాతిపదిక సంకలన చర్య) :
ప్రశ్న 25.
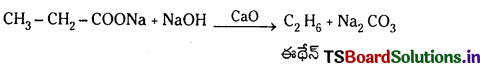
సోడియం ప్రోపనోయేట్ను సోడా లైమ్ వేడిచేస్తే ఏ ఉత్పన్నం ఏర్పడుతుంది?
జవాబు:
సోడియం ప్రోపనోయేట్ను సోడాలైమ్తో వేడిచేస్తే ఈథేన్ ఏర్పడుతుంది. సోడాలైమ్ అనగా NaOH +
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 26.
హైడ్రోకార్బన్ల వర్గీకరణను వివరించండి.
జవాబు:
హైడ్రోకార్బన్ల వర్గీకరణ
ప్రశ్న 27.
కింది సమ్మేళనాల IUPAC నామాలు రాయండి.
(a) CH2 = CH – CH = CH2
(b) CH2 = CH – C ≡ C-CH3
(c) CH3CH = C[CH3]2
(d) ![]() CH2-CH2 CH = CH2
CH2-CH2 CH = CH2
(e)
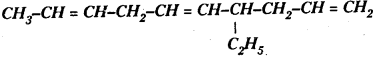
జవాబు:
(a) 1, 3 – బ్యూటా డై ఈన్
(b) పెంట్ 1 – ఈన్ – 3 – ఐన్
(c) 2-మిథైల్-2-బ్యూటీన్
(d) 4-ఫినైల్ 1-బ్యూటీన్
(e) 4-ఈథైల్ డెకా 1, 5, 8 ట్రైఈన్
ప్రశ్న 28.
ఈథేన్ ను తయారుచేసే రెండు పద్ధతులను, ఏవైనా ఈథేన్ మూడు చర్యలను రాయండి. (March 2013)
జవాబు:
ఈథేన్ ను తయారు చేయు పద్ధతులు :
1. ఆల్కైల్ హాలైడ్ల నుంచి : ఈథైల్ హాలైడ్లను Zn, సజల HCl సమక్షంలో క్షయకరణం చెందించి ఈథేన్ తయారుచేస్తారు.
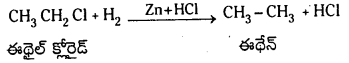
2. ఉర్ట్ చర్య : మిథైల్ బ్రోమైడ్ను పొడి ఈథర్లో తీసుకుని సోడియంతో వేడిచేస్తే ఈథేన్ ఏర్పడుతుంది. ఈ చర్యనే ఉ చర్య అంటారు.
![]()
ఈథేన్ యొక్క ధర్మాలు : ఈథేన్ సాధారణంగా ప్రతిక్షేపణ చర్యలను జరుపుకుంటుంది. ఈ చర్యలలో ఒక పరమాణువు లేదా సమూహం ఇంకొక పరమాణువు లేదా సమూహంలో ప్రతిక్షేపించబడతాయి.
ఉదా :
1. హాలోజనీకరణం : ఈథేన్ ను UV కిరణాల సమక్షంలో Cl2 తో చర్య జరిపిస్తే, ఈథేన్ ని H పరమాణువులు Cl పరమాణువులతో ప్రతిక్షేపణం చెందుతాయి.
![]()
2. నైట్రేషన్ : ఈథేన్ 400°C వద్ద HNO3 తో చర్య జరిపి నైట్రో ఈథేనన్ను ఏర్పరచును. ఈ చర్యనే నైట్రేషన్ అంటారు.
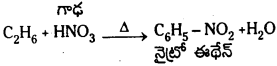
3. దహనచర్య : గాలి లేదా డై ఆక్సిజన్ సమక్షంలో ఈథేన్ వేడిచేస్తే CO2, H2O లను ఏర్పరుస్తుంది. ఈ చర్యలో అధిక శక్తి విడుదలవుతుంది. ఈ చర్యను దహన చర్య అంటారు.
C2H6 + \(\frac{7}{2}\)O2 → 2 CO2 + 3 H2O + శక్తి
ప్రశ్న 29.
కింద ఇచ్చిన ఫార్ములాలు ఏర్పరచగలిగిన సాదృశ్యాలను రాసి వాటి నిర్మాణాలు, IUPAC పేర్లు రాయండి :
(a) C4H8 (ఒక ద్విబంధం)
(b) C5H8 (ఒక త్రిబంధం)
(c) C5H12 (బహుబంధాలు లేవు)
జవాబు:

![]()
ప్రశ్న 30.
కింది హైడ్రోకార్బన్లు దహనచర్యలో జరిపే చర్యలను సమీకరణ రూపంలో రాయండి.
(a) బ్యూటేన్
(b) పెంటీన్
(c) హెక్సెన్
జవాబు:
(a) బ్యూటేన్ దహనచర్య
C4H10 + \(\frac{13}{2}\)O2 → 4 CO2 + 5H2O + శక్తి
(b) పెంటీన్ దహనచర్య
C5H10 + \(\frac{15}{2}\)O2 → 5 CO2 + 5H2O + శక్తి
(c) హెక్సెన్ దహనచర్య
C6H10 + \(\frac{17}{2}\)O2 → 6 CO2 + 5H2O + శక్తి
ప్రశ్న 31.
ప్రోపీన్ HBr సంకలనం చెంది 2–బ్రోమో ప్రోపేన్ను ఇస్తుంది. అదే బెంజాయిల్ పెరాక్సైడ్ సమక్షంలో 1–బ్రోమోప్రోపేన్ ఏర్పడుతుంది. చర్యాగతిని రాసి తేడాను వివరించండి.
జవాబు:
ప్రోపీన్ తో HBr సంకలనం చెంది మార్కొనికాఫ్ నియమము ప్రకారం 2-బ్రోమో ప్రోపేన న్ను ఇస్తుంది. కాని బెంజాయిల్ పెరాక్సైడ్ సమక్షంలో ప్రోపీన్కు HBrను కలిపితే 1-బ్రోమో ప్రోపేన్ ఏర్పడుతుంది. ఇక్కడ యాంటి మార్కొనికాఫ్ నియమము ప్రకారము సంకలనం జరుగుతుంది.
మార్కొనికాఫ్ నియమము : ఒక అసమకారకం ద్విబంధంలో సంకలనం చెందేటపుడు అసమకారకం రుణావేశ భాగం ద్విబంధంలో తక్కువ హైడ్రోజన్లున్న కార్బన్పై సంకలనం చెందుతుంది.
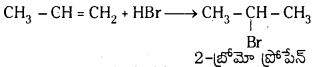
చర్యావిధానము (ఎలక్ట్రోఫిలిక్ సంకలన చర్య) :
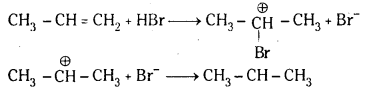
యాంటి మార్కొనికాఫ్ నియమము : ఒక అసమకారకం ద్విబంధంతో పెరాక్సైడ్ సమక్షంలో సంకలనం చెందేటపుడు అసమకారకం రుణావేశ భాగం ద్విబంధంలో ఎక్కువ హైడ్రోజన్లున్న కార్బన్పై సంకలనం చెందుతుంది. దీనినే ఖారాష్ ప్రభావం అని కూడా అంటారు.
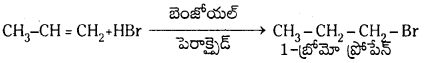
చర్యావిధానం (స్వేచ్ఛా ప్రాతిపదిక సంకలన చర్య) :
ప్రశ్న 32.
ఇథిలీన్ తయారుచేయడానికి రెండు విధానాలు తెలపండి. ఇథిలీన్ కింది వాటితో ఏర్పరిచే ఉత్పన్నాల చర్యలను తెలపండి.
(a) ఓజోన్
(b) హైపోహాలస్ ఆమ్లం
(c) చల్లని విలీన క్షార KMnO4
(d) అధిక పీడనం వద్ద O2 తో వేడిచేయుట
జవాబు:
ఇథిలీన్ ను తయారుచేయు పద్ధతులు :
1. డీహైడ్రోహాలోజనీకరణం : ఇథైల్ హాలైడ్లను ఆల్కహాలిక్ KOH తో వేడిచేయగా ఇథిలీన్ ఏర్పడుతుంది.
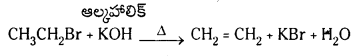
2. ఇథైల్ ఆల్కహాల్ను గాఢ H2SO4 సమక్షంలో 170°C వద్ద వేడిచేస్తే ఇథిలీన్ ఏర్పడుతుంది.
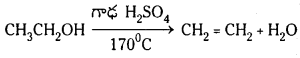
ఇథిలీన్ చర్యలు :
(a) ఓజోన్తో చర్య : ఇథిలీన్ ఓజోన్ తో చర్య జరిపి అస్థిరమైన ఇథిలీన్ ఓజోనైడ్ను ఏర్పరుస్తుంది. ఇది Zn/H2O సమక్షంలో వియోగం చెంది ఫార్మాల్డిహైడు ఏర్పరుస్తుంది.
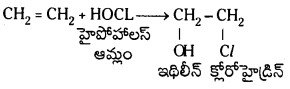
(b) హైపోహాలస్ ఆమ్లంతో చర్య : ఇథిలీన్ HOCl తో చర్య జరిపి ఇథిలీన్ – క్లోరోహైడ్రినన్ను ఏర్పరుస్తుంది.
(c) చల్లని, విలీన, క్షార KMnO4 తో చర్య : ఇథిలీన్ KMnO4 తో చర్య జరిపి ఇథిలీన్ గ్లైకాల్నిస్తుంది. చల్లని విలీన
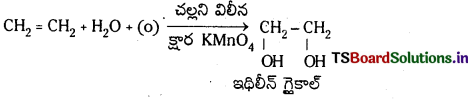
(d) అధిక పీడనం వద్ద O2తో చర్య : అధిక పీడనం వద్ద మరియు 200°C వద్ద ఇథిలీన్ O2 తో చర్య జరిపిస్తే పాలిమరీకరణం జరుపుకొని పాలిథీన్ ను ఏర్పరుస్తుంది.
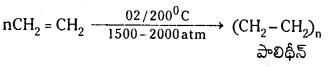
ప్రశ్న 33.
కింది వాటితో ఇథిలీన్ చర్యలు రాయండి. సమీకరణాలు రాసి ఉత్పన్నాల పేర్లు రాయండి.
(a) హైడ్రోజన్ హాలైడ్
(b) హైడ్రోజన్
(c) బ్రోమీన్
(d) నీరు
(e) సిల్వర్ సమక్షంలో 200°C వద్ద ఆక్సిజన్తో చర్య
జవాబు:
ఇథిలీన్ – చర్యలు
(a) హైడ్రోజన్ హాలైడ్తో
చర్య: ఇథిలీన్ హైడ్రోజన్ హాలైడ్లో చర్యజరిపి ఇథైల్హాలైడ్లనిస్తుంది.
CH2 = CH2 + HX → CH3 – CH2X
ఉదా :
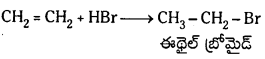
(b) హైడ్రోజన్తో చర్య : ఇథిలీన్ నికెల్ సమక్షంలో H2 తో చర్యజరిపి ఈథేన్ ను ఏర్పరుస్తుంది.
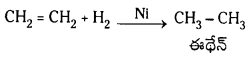
(c) బ్రోమీన్ చర్య : ఇథిలీన్ CCl4 సమక్షంలో బ్రోమిన్తో చర్యజరిపి 1, 2 – డైబ్రోమో ఈథేన్ను ఏర్పరుస్తుంది.
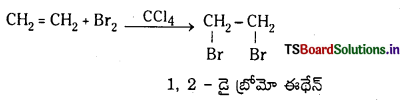
(d) నీటితో చర్య ఇథిలీన్ ఆమ్లీకృత నీటితో చర్య జరిపి ఈథైల్ ఆల్కహాల్ను ఏర్పరుస్తుంది.
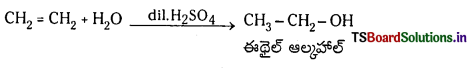
(e) సిల్వర్ సమక్షంలో 200°C O2 తో చర్య : ఇథిలీన్ 200-400°C వద్ద సిల్వర్ సమక్షంలో ఆక్సిజన్తో చర్య జరిపి ఇథిలీన్ ఆక్సైడ్ను ఏర్పరుస్తుంది.
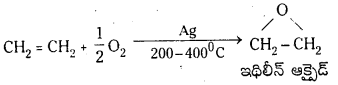
ప్రశ్న 34.
‘A’ అను ఆల్కీన్ ఓజోనాలిసిస్ చర్యలో పాల్గొని ఇథనాల్, పెంటేన్-3-ఓన్ల మిశ్రమాన్ని ఏర్పరుస్తుంది. చర్యను రాసి, ఉత్పన్నాల, ఆల్కీన్ -Aల నిర్మాణాలు రాసి వాటి IUPAC పేరును తెల్పండి.
జవాబు:
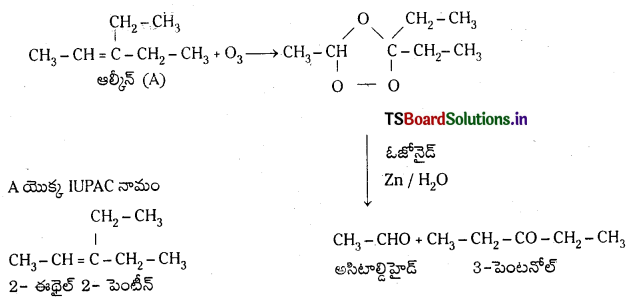
![]()
ప్రశ్న 35.
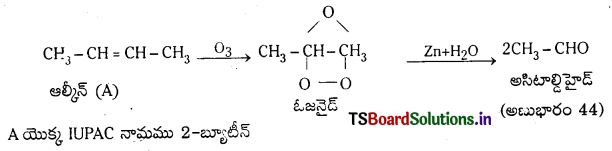
‘A’ అనే ఆల్కీన్లో మూడు C – C ఎనిమిది C – H బంధాలు, ఒక C=C ద్విబంధం ఉన్నాయి. ఓజోనాలిసిస్ చర్యలో ‘A’ ఆల్కీన్ రెండు అణువుల ఆల్డిహైడ్ (అణుభారం 44)ను ఏర్పరుస్తుంది. ‘A’ యొక్క IUPAC పేరును రాయండి.
జవాబు:
ప్రశ్న 36.
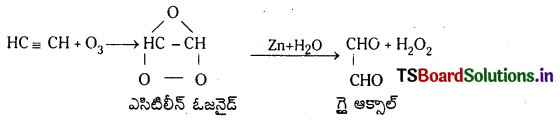
ఎసిటిలీన్ తయారుచేయడానికి రెండు పద్ధతులను తెలపండి. ఎసిటిలీన్ నీటితో, ఓజోన్ తో జరుపు చర్యలు రాయండి.
జవాబు:
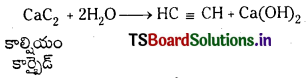
ఎసిటిలీన్ తయారుచేయు పద్ధతులు :
1. కాల్షియంకార్బైడ్ నుండి : కాల్షియం కార్బైడు జలవిశ్లేషణ చేయుట ద్వారా పారిశ్రామికంగా ఎసిటిలీన్ ను తయారు చేయవచ్చు.
2. అయొడీఫారం నుండి : అయొడీఫారంను సిల్వర్ పొడితో వేడిచేయగా ఎసిటిలీన్ ఏర్పడుతుంది.
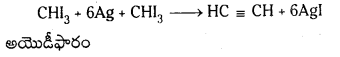
రసాయన ధర్మాలు :
1. నీటితో చర్య : ఎసిటిలీన్ HgSO4 మరియు H2SO4 సమక్షంలో 60°C వద్ద నీటితో చర్య జరిపి అస్థిర వినైల్ ఆల్కహాల్ను ఏర్పరుస్తుంది. ఇది పునర్వ్యవస్థీకరణం చెంది అసిటాల్డిహైడ్ ను ఏర్పరుస్తుంది.
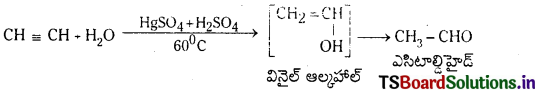
2..ఓజోన్ చర్య : ఎసిటిలీన్ ఓజోన్ తో సంకలనం చెంది అస్థిర ఎసిటిలీన్ ఓజోనైడ్ను ఏర్పరుస్తుంది. ఇది. Zn/H2O సమక్షంలో వియోగం చెంది గైఆక్సాల్ను ఏర్పరుస్తుంది.
![]()
ప్రశ్న 37.
ఎసిటిలీన్ కిందివానితో ఏ విధంగా చర్య జరుపుతుంది? ఉత్పన్నాల పేర్లను రాసి చర్యలు రాయండి.
(a) ఎసిటిక్ ఆమ్లం
(b) నీరు
(c) హైడ్రోజన్
(d) హాలోజన్లు
(e) హైడ్రోజన్ హాలైడ్
(f) అమ్మోనికల్ సిల్వర్ నైట్రేట్, Cu2Cl2
జవాబు:
(a) ఎసిటిక్ ఆమ్లంతో చర్య : ఎసిటిలీన్, Hg+2 అయాన్ల సమక్షంలో ఎసిటిక్ ఆమ్లంతో చర్య జరిపి మొదట వినైల్ ఎసిటేట్ ను తరువాత ఇథిలిడీన్ డైఎసిటేట్ను ఏర్పరుస్తుంది.
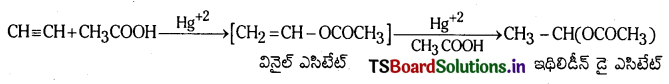
(b) నీటితో చర్య : ఎసిటిలీన్ HgSO4 మరియు H2SO4 సమక్షంలో 60°C వద్ద నీటితో చర్య జరిపి అస్థిర వినైల్ ఆల్కహాల్ను ఏర్పరుస్తుంది. ఇది పునర్వ్యవస్థీకరణం చెంది అసిటాల్డిహైడు ఏర్పరుస్తుంది.
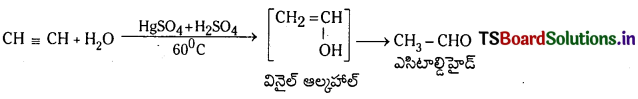
(c) హైడ్రోజన్ చర్య : ఎసిటిలీన్ Ni ఉత్ప్రేరకం సమక్షంలో H2 తో వేడిచేయగా సంకలనం చెంది మొదట ఇథిలీన్ ను తరువాత ఈథేన్ ను ఏర్పరుస్తుంది. ఈ చర్యను సెబాటియర్ – సెండరెన్స్ చర్య అంటారు.
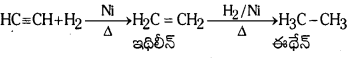
(d) హాలోజన్తో చర్య : ఎసిటిలీన్ క్లోరిన్తో సంకలన చర్య జరిపి మొదట 1, 2 – డై క్లోరో ఈథేన్ ను తరువాత 1, 1, 2, 2 – టెట్రాక్లోరో ఈథేనన్ను ఏర్పరుస్తుంది.
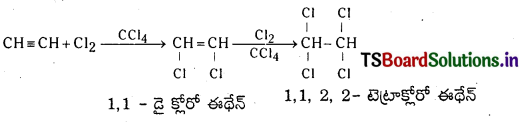
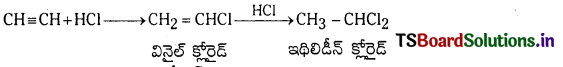
(e) హైడ్రోజన్ హాలైడ్లో చర్య : ఎసిటిలీన్ HCl తో చర్య జరిపి మొదట వినైల్ క్లోరైడ్ను ఆ తరువాత ఇథిలిడీన్ క్లోరైడ్ను ఏర్పరుస్తుంది.
(f) అమ్మోనికల్ AgNO3 మరియు Cu2 Cl2 తో చర్యలు :
ఎసిటిలీన్ వాయువును అమ్మోనికల్ AgNO3 ద్రావణం గుండా పంపినపుడు, సిల్వర్ ఎసిటిలైడ్ అవక్షేపం ఏర్పడుతుంది.
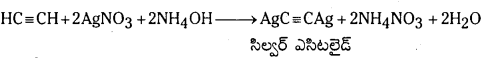
ఎసిటిలీన్ వాయువును అమ్మోనికల్ Cu2Cl2 ద్రావణం గుండా పంపినపుడు, క్యూప్రస్ ఎసిటిలైడ్ అవక్షేపం ఏర్పడుతుంది.
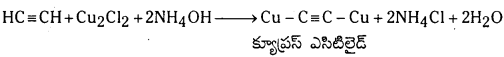
ప్రశ్న 38.
బెంజీన్ను తయారుచేసే ఏవైనా రెండు పద్ధతులను రాసి వాటి సమీకరణాలు రాయండి. బెంజీన్ ఆల్కీన్ లక్షణాలను చూపించదు – ఎందుకని? బెంజీన్ నుంచి మీథైల్ బెంజీన్ ను ఎలా తయారుచేస్తారు?
జవాబు:
బెంజీన్ ను తయారు చేయు పద్ధతులు
(a) డీ కార్బాక్సిలీకరణం : సోడియం బెంజోయేట్ను సోడాలైమ్ (NaOH + CaO) తో వేడిచేయగా బెంజీన్ ఏర్పడుతుంది.
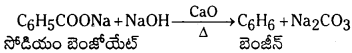
(b) ఫినోల్ క్షయకరణం : ఫినోల్ను జింక్ పొడితో వేడిచేయగా అది క్షయకరణం చెంది బెంజీన్ ఏర్పడుతుంది.
![]()
బెంజీన్ అణుఫార్ములా ఆల్కీన్ల వలె అసంతృప్తతను తెలియచేసినప్పటికి, ఇది అత్యంత స్థిరంగా ఉంటూ సంకలన చర్యల కంటే ప్రతిక్షేపణ చర్యలను ఎక్కువగా జరుపుతుంది. కారణం
- బెంజీన్లోని π – ఎలక్ట్రాన్లు అస్థానీకృతం చెందుతాయి.
- బెంజీన్ కున్న అధిక రెజోనెన్స్ శక్తి వలన దానికి అధిక స్థిరత్వం వస్తుంది. కావున ఇది ఆల్కీన్ల వలె ప్రవర్తించదు.
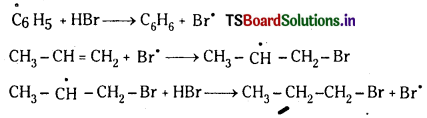
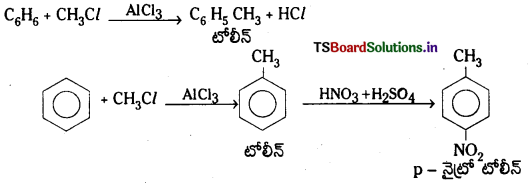
(c) బెంజీన్ నుంచి మిథైల్ బెంజీన్ ను తయారు చేయుట : బెంజీన్ అనార్ద్ర Al Cl3 సమక్షంలో మిథైల్ క్లోరైడ్తో చర్య జరిపి మిథైల్ బెంజీన్ లేక టోలిన్ ను ఏర్పరుస్తుంది.
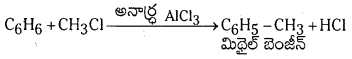
ప్రశ్న 39.
ఎసిటిలీన్ నుంచి బెంజీన్ ఎట్లా ఏర్పడుతుంది? సమీకరణం రాయండి. బెంజీన్ యొక్క హాలోజినేషన్, ఆల్కైలేషన్, ఎసైలేషన్, నైట్రేషన్, సల్ఫోనేషన్ చర్యలను వివరించండి.
జవాబు:
ఎసిటిలీన్ నుండి బెంజీన్ ను తయారు చేయుట : ఎసిటిలీన్ వాయువును ఎర్రగా కాలుచున్న కాపర్ గొట్టాల గుండా పంపినపుడు అది పాలిమరీకరణ చెంది బెంజీన్ ఏర్పడుతుంది.
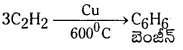
బెంజీన్ యొక్క ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్యలు :
1. హాలోజినేషన్ (హాలోజనీకరణం) : బెంజీన్ న్ను FeCl3 సమక్షంలో క్లోరిన్తో చర్య జరపగా క్లోరో బెంజీన్ ఏర్పడుతుంది..
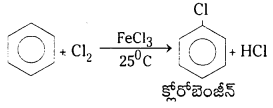
2. ఆల్కైలేషన్ (ఆల్కైనీకరణం) : బెంజీన్ AlCl3 సమక్షంలో ఆల్కైల్ హాలైడ్లతో చర్య జరిపి ఆల్కైల్ బెంజీన్ ను ఏర్పరుస్తుంది.
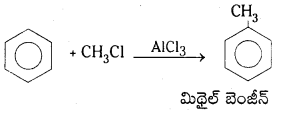
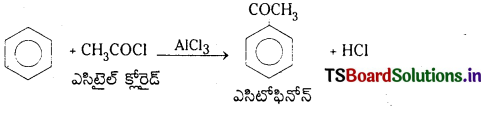
3. ఎసైలేషన్ : బెంజీన్, AlCl3 సమక్షంలో ఎసైల్ క్లోరైడ్తో చర్య జరిపి ఎసైల్ బెంజీన్ ను ఏర్పరుస్తుంది.
4. నైట్రేషన్ (నైట్రోకరణం) : బెంజీన్ ను నైట్రేషన్ మిశ్రమంతో (గాఢ HNO3 + గాఢ H2SO4) 60°C కన్నా తక్కువ ఉ ష్ణోగ్రత వద్ద చర్య జరుపగా నైట్రో బెంజీన్ ఏర్పడుతుంది.
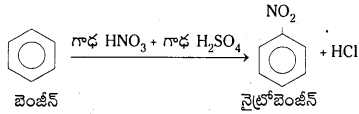
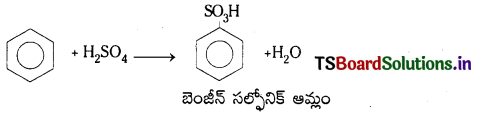
5. సల్ఫోనేషన్ (సల్ఫోనీకరణం): బెంజీన్ సల్ఫ్యూరిక్ ఆమ్లంతో చర్య జరిపి బెంజీన్ సల్ఫోనిక్ ఆమ్లంను ఏర్పరుస్తుంది.
ప్రశ్న 40.
నిర్మాణ సాదృశ్యాలు, త్రిమితీయ సాదృశ్యాల మధ్య తేడాలు వివరించండి.
జవాబు:
నిర్మాణాత్మక సాదృశ్యము:
- అణువులోని పరమాణువుల లేదా సమూహాల అమరికలో తేడా వలన నిర్మాణాత్మక సాదృశ్యము ఏర్పడుతుంది. ఈ సాదృశ్యములకు ఒకే అణు ఫార్ములా ఉండి వేరు వేరు నిర్మాణాత్మక ఫార్ములాలు ఉంటాయి.
- శృంఖల సాదృశ్యం, స్థానసాదృశ్యం, వలయశృంఖల సాదృశ్యం, ప్రమేయ సమూహ సాదృశ్యం, మెటామెరిజం, టాటామెరిజం మొదలగునవి నిర్మాణాత్మక సాదృశ్య రకానికి చెందినవి.
- ఇవి ద్విమితీయంగా ఉంటాయి.
త్రిమితీయ సాదృశ్యము :
- ఒకే అణుఫార్ములా మరియు నిర్మాణాత్మక ఫార్ములా కలిగి ఉండి, త్రిమితీయంగా పరమాణువులు లేదా గ్రూపుల ప్రాదేశిక అమరికలో భేదం వలన వచ్చు సాదృశ్యమును త్రిమితీయ సాదృశ్యము అంటారు.
- క్షేత్ర సాదృశ్యము, దృక్ సాదృశ్యము, అనురూపక సాదృశ్యము మొదలగునవి త్రిమితీయ సాదృశ్య రకానికి చెందినవి.
- ఇవి త్రిమితీయంగా ఉంటాయి.
ప్రశ్న 41.
సరళ శృంఖలాలు అనురూపత, విన్యాసంలందు తేడా ఏమిటి?
జవాబు:
అనురూపత లేదా అనురూపక సాదృశ్యాలు :
- ఇవి త్రిమితీయ సాదృశ్యాలు. ఒక రూపం నుండి మరొక రూపంలోనికి C – C బంధాల భ్రమణం వలన మార్పు చెందుతాయి. ఇవి ఒకదానితో ఒకటి గతిక సమతాస్థితిలో ఉంటాయి.
- సాధారణ పరిస్థితులలో వీటిని వేరు చేయలేము.
ఉదా : ఈథేన్ యొక్క E and S నిర్మాణాలు
విన్యాసం లేదా విన్యాస సాదృశ్యాలు :
1. ఇవి కూడా త్రిమితీయ సాదృశ్యాలు. ఇవి స్థిరమైనవి. ఇవి ఒక రూపం నుండి వేరొక రూపంలోకి మార్పు చెందవు.
2. ఒక రూపం నుండి వేరొక రూపంలోనికి మార్పు చెందుటకు బంధాలు విడిపోయి కలవవలెను. ఇవి రెండు రకాలు.
1. క్షేత్ర సాదృశ్యాలు : ఈ సాదృశ్యాలలో ద్విబంధంతో బంధించబడి ఉన్న కార్బన్ పరమాణువుల చుట్టూ ఉన్న పరమాణువుల లేక గ్రూపుల అమరికలో తేడా ఉంటుంది.
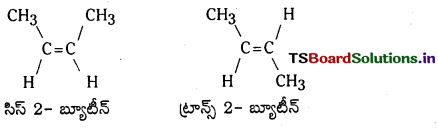
ఉదా : సిస్ 2-బ్యూటీన్ మరియు ట్రాన్స్ 2-బ్యూటీన్
2. దృశా సాదృశ్యాలు (ఆప్టికల్ ఐసోమర్లు) : ఈ సాదృశ్యాలలో అణువులోని కార్బన్ పరమాణువును అతకబడిన నాలుగు విభిన్న పరమాణువుల లేక రాడికల్స్ ప్రాదేశిక అమరికలో తేడా ఉంటుంది.
![]()
ప్రశ్న 42.
క్షేత్ర సాదృశ్యం అంటే ఏమిటి? 2-బ్యూటీన్ క్షేత్ర సాదృశ్యాలను రాయండి.
జవాబు:
ద్విబంధంతో బంధింపబడి ఉన్న కార్బన్ పరమాణువుల చుట్టూ ఆవరించి ఉన్న పరమాణువుల లేక గ్రూపుల అమరికలో తేడా వలన ఏర్పడే సాదృశ్యాన్ని క్షేత్ర సాదృశ్యం అంటారు.
ఉదా : 2-బ్యూటీన్కు క్రింది క్షేత్ర సాదృశ్యాలు ఉన్నాయి.
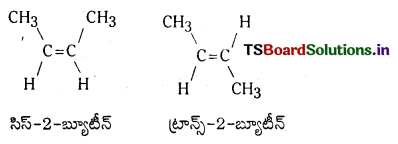
ఒకే రకమైన సమూహాలు ద్విబంధానికి ఒకే వైపున బంధాలేర్పరచి ఉంటే ఆ సాదృశ్యమును సిస్ సాదృశ్యమని, ఒకే రకమైన సమూహాలు ద్విబంధానికి వ్యతిరేకదిశలో బంధాలు ఏర్పరచి ఉంటే ట్రాన్స్ సాదృశ్యమని అంటారు.
ప్రశ్న 43.
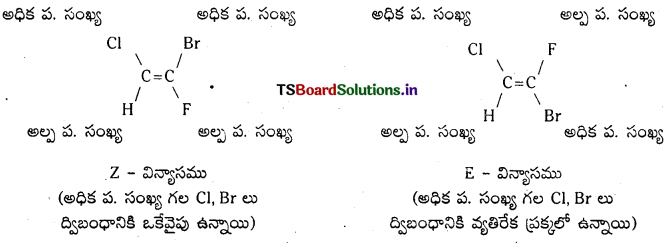
E-Z విన్యాసాలను గుర్తించే పద్ధతిని తెలిపి, CHCl = CFBr అణువుకు క్షేత్ర సాదృశ్యాలను రాయండి.
జవాబు:
ఈ పద్ధతి పరమాణు సంఖ్యల విలువలపై ఆధారపడి ఉంటుంది. ద్విబంధ కార్బన్ల మీద గ్రూపులు అధిక పరమాణు సంఖ్యలు గల పరమాణువుకు ద్విబంధ కార్బన్లు ఒకే వైపు బంధాలు ఏర్పరచి ఉంటే దానిని ‘Z’ విన్యాసం అనీ, అదే అధిక పరమాణు సంఖ్యల పరమాణువులు ద్విబంధానికి వ్యతిరేక ప్రక్కల బంధించబడి ఉంటే దానిని ‘E’ విన్యాసం అని అంటారు.
ఉదా : CHCl = CFBr
ప్రశ్న 44.
ఒక ఆల్కీన్లో ద్విబంధం వద్ద ఉన్న కార్బన్లపై Cl, Br, -CH2,-CH2-OH, CH (CH3)2 సమూహాలుంటే దాని E, Z విన్యాసాలు రాయండి.
జవాబు:

ప్రశ్న 45.
కింది వాటిని వివరించండి.
(a) స్వేదనం
(b) అంశిక స్వేదనం
(c) తక్కువ పీడనంలో స్వేదనం
(d) జలబాష్ప స్వేదనం
జవాబు:
(a) స్వేదనం : ఈ పద్ధతి
1) బాష్పశీల ద్రవాల నుంచి అబాష్పశీల మలినాలను వేరుచేయడానికి
2) బాష్పీభవన స్థానాలలో సరిపడ తేడా ఉన్న ద్రవాల మిశ్రమాన్ని వేరు చేయడానికి ఉపయోగిస్తారు.
విభిన్న బాష్పీభవన స్థానాలు ఉన్న ద్రవాలు వేరువేరు ఉష్ణోగ్రతల వద్ద పూర్తిగా బాష్పాలుగా మారతాయి. ఈ బాష్పాలను చల్లబరిస్తే ఏర్పడే ద్రవాలను వేరుగా సంగ్రహించవచ్చు.
ఉదా : క్లోరోఫారం (ద్ర. స్థానం 334K) మరియు ఎనిలీన్ (ద్ర. స్థానం 457K) మిశ్రమాన్ని స్వేదన పద్ధతిలో వేరుచేస్తారు.
(b) పాక్షిక అంశిక స్వేదనం : మిశ్రమంలోని రెండు ద్రవాల బాష్పీభవన స్థానాలలో తేడా తక్కువగా ఉన్నప్పుడు వీటి బాష్పాలు ఒకే ఉష్ణోగ్రత వద్ద ఏర్పడి ఒకేసారి ద్రవీకరణం చెందుతాయి. ఈ ద్రవాలను వేరు చేయడానికి పాక్షిక అంశిక స్వేదనాన్ని ఉపయోగిస్తారు.
ఈ పద్ధతిలో ద్రవాల మిశ్రమ బాష్పాలను ద్రవీకరణానికి ముందు అంశీకరణ నాళిక ద్వారా పంపించాలి. అంశిక నాళికను స్వేదన కుప్పె మూతికి బిగించాలి. ఇక్కడ ముఖ్య సూత్రం మిశ్రమ బాష్పాలు పొడవాటి అంశిక నాళికలో ప్రయోగించినపుడు ఎక్కువ బాష్పీభవన స్థానం ఉన్న ద్రవపు బాష్పం ముందుగా చల్లబడి ద్రవీకరణం చెంది స్వేదన కుప్పెలో చేరగా, తక్కువ బాష్పీభవన స్థానం ఉన్న ద్రవపు బాష్పం కండెన్సర్ ద్వారా ప్రయాణించి చల్లబడి ద్రవీకరణం చెంది సంగ్రహణ పాత్రను చేరుతుంది.
(c) తక్కువ పీడనంలో స్వేదనం : ఈ విధానం అధిక బాష్పీభవన స్థానాలున్న ద్రవాల్ని లేదా బాష్పీభవన స్థానాల కంటే తక్కువ ఉష్ణోగ్రతల వద్దనే వియోగం చెందే ద్రవాల్ని శుద్ధి చేయడానికి ఉపయోగపడుతుంది. బాష్పపీడనం తగ్గిస్తే ద్రవం తక్కువ ఉష్ణోగ్రత వద్దే ఎటువంటి వియోగమూ చెందకుండా బాష్పీభవనం చెందుతుంది. వచ్చిన బాష్పాల్ని చల్లబరచి పరిశుద్ధ ద్రవాన్ని పొందవచ్చు. మలినాలు స్వేదనం కుప్పెలో మిగులుతాయి.
ఉదా : గ్లిసరాలు సబ్బు పరిశ్రమలో ఉపయోగించిన గాఢ క్షార ద్రావణం నుంచి ఈ పద్ధతిలో వేరు చేయవచ్చు.
(d) జలబాష్ప స్వేదనం : ఈ పద్ధతిలో నీటిలో కరగని, జలబాష్పంతో బాష్పశీలత పొందే ద్రవాల్ని శుద్ధి చేస్తారు. ఈ విధానంలో వేడి మలిన ద్రవంలోకి నీటి ఆవిరిని పంపిస్తారు. ఈ నీటి ఆవిరి ద్రవబాష్పం రెండూ కండెన్సర్ ద్వారా ప్రయాణించి ద్రవ మిశ్రమమై సంగ్రహణ పాత్రలో చేరతాయి. అవి ఒకదానితో ఒకటి కలిసిపోవు. కాబట్టి వేర్పాటు గరాటుతో ‘నీటి నుంచి పదార్థాన్ని వేరుచేయవచ్చు.
ఉదా : ఈ పద్ధతిలో ఎనిలీన్ ను ఎనిలీన్-నీరు మిశ్రమం నుంచి వేరు చేయవచ్చు.
ప్రశ్న 46.
క్రోమటోగ్రఫీని విశదీకరించండి.
జవాబు:
ఒక మిశ్రమంలోని అనుఘటకాలను స్థిరప్రావస్థ, చలనశీల ప్రావస్థ అనే రెండు ప్రావస్థల మధ్య వేరు పరిచే విధానాన్ని క్రోమటోగ్రఫీ అంటారు.
క్రోమటోగ్రఫీలో క్రింది మూడు దశలు ఇమిడి ఉంటాయి.
- స్థిర ప్రావస్థ మిశ్రమంలోని అనుఘటకాలను శోషించుకుని స్థిరంగా పట్టి ఉంచుతుంది. చలన శీల ప్రావస్థ ఆ అధిశోషించుకోబడిన అనుఘటకాలను వేరు పరచి స్థిర ప్రావస్థపై విభిన్న దూరాలకు తీసుకుపోతుంది.
- పై విధంగా వేరు పరచబడిన అనుఘటకాలను చలనశీల ప్రావస్థను ఆపకుండా పంపి తిరిగి పొందడం. దీనిని నిక్షాళన అంటారు.
- గుణాత్మక, పరిమాణాత్మక విశ్లేషణల ద్వారా నిక్షాళనం చేసి సాధించిన సమ్మేళనాలను తెలుసుకోవడం. అధిశోషణి, చలనశీల ప్రావస్థల భౌతిక స్థితులపై ఆధారపడి క్రోమటోగ్రఫీ పద్ధతులు అనేక రకాలుగా వర్గీకరింపబడ్డాయి.
సాధారణ క్రోమటోగ్రఫీలో రెండు పద్ధతులు ఉన్నాయి. అవి
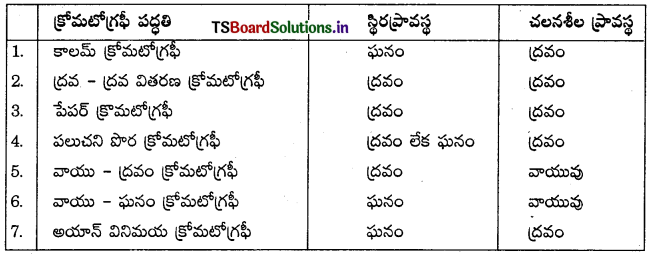
- అధిశోషణ క్రోమటోగ్రఫీ
- వితరణ క్రోమటోగ్రఫీ అధిశోషణ క్రోమటోగ్రఫీ మరల రెండు రకాలు. అవి
- కాలమ్ క్రోమటోగ్రఫీ
- పలుచనిపొర క్రోమటోగ్రఫీ.
ప్రశ్న 47.
కింది వాటిని వివరించండి :
(a) కాలమ్ క్రొమటోగ్రఫి
(b) పలచని పొర క్రొమటోగ్రఫి
(c) వితరణ క్రొమటోగ్రఫీ
జవాబు:
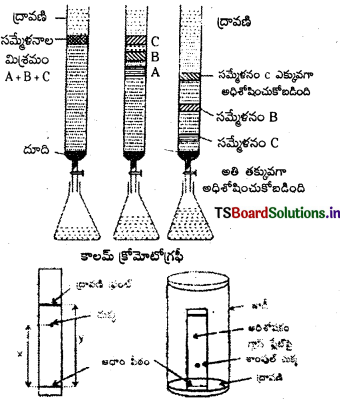
(a) కాలమ్ క్రొమటోగ్రఫి : దీనిలో స్టాప్ కాక్ అమరిక గల ఒక గాజు గొట్టంలో నింపి ఉన్న అధిశోషకం (స్థిరప్రావస్థ)పై భాగాన అనుఘటకాల మిశ్రమాన్ని ఉంచాలి. సరియైన నిక్షాలకాన్ని కాలమ్ పై నుండి కిందికి నెమ్మదిగా ప్రవహింపచేయాలి. అప్పుడు మిశ్రమంలోని అనుఘటకాలు విభిన్న అవధులలో అధిశోషణం చెంది వేరు అవుతాయి.
(b) పలచని పొర క్రొమటోగ్రఫి : ఈ పద్ధతిలో అధిశోషకంగా వాడే సిలికాజెల్ను లేక అల్యూమినాను ఒక గాజు ప్లేటుపై పలుచని పొరగా పూత పూస్తారు. దీనిని TLC ప్లేట్ అంటారు. అనుఘటకాలను కలిగి ఉన్న మిశ్రమ ద్రావణాన్ని TLC ప్లేట్ కింది నుండి 2 లేక 3 సెం.మీ. దూరంలో ఒక చిన్న చుక్కగా ఉంచుతారు. ఈ ప్లేటును నిక్షాలకం కలిగి ఉన్న మూసిన పాత్రలో ‘ఉంచుతారు. నిక్షాలకం పైకి ప్రవహిస్తూ తనతో పాటు . మిశ్రమంలోని అనుఘటకాలను తీసికొని పోతుంది. కాని అనుఘటకాల అధిశోషణ అవధులపై ఆధారపడి అవి వివిధ దూరాలు ప్రయాణించి వేరువేరు చోట్ల అధిశోషితం అవుతాయి.
ఒక అనుఘటకం సాపేక్ష అధిశోషణం దాని మందన గుణకం Rf తో తెలుపుతారు.
అనుఘటకం ఆధారపీఠం గీత నుండి ప్రయాణించిన దూరం
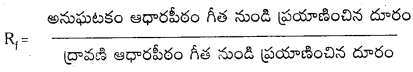
ఈ పద్ధతి ద్వారా రంగులున్న అనుఘటకాలను తేలికగా గుర్తిస్తారు. రంగులేని వాటిని వాటి ప్రతిదీప్తి ధర్మం ఆధారంగా చేసుకొని UV కిరణాలను ఉపయోగించి గుర్తిస్తారు.
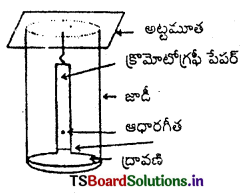
(c) వితరణ క్రోమటోగ్రఫీ : దీనిలో క్రొమటోగ్రఫీ పేపర్ను తీసికొని నీటిని దానిలో ఉంచుతారు. ఈ నీరు స్థిర ప్రావస్థగా పనిచేస్తుంది. ఈ పేపర్ ఆధారపీఠ గీతపై అనుఘటకాల మిశ్రమ ద్రావణాన్ని చుక్కగా పెట్టి దానిని సరియైన ద్రావణిలో వ్రేలాడదీస్తారు. ద్రావణి చలనశీల ప్రావస్థగా పనిచేస్తుంది. ద్రావణి, పేపర్ పైకి ప్రయాణించి మిశ్రమ బొట్టు మీదుగా పోతుంది. అప్పుడు పేపరు విభిన్న అనుఘటకాలను ప్రత్యేకంగా తనపై నిలుపుకొంటుంది. అనుఘటకాలు వాటి అభిలాక్షణిక ధర్మాలపై ఆధారపడి స్థిర ప్రావస్థ చలన శీల ప్రావస్థల మధ్య వేర్వేరుగా వితరణ చెందుతాయి. విడగొట్టబడిన రంగుల అనుఘటకాల . చుక్కలను పేపరుపై గుర్తించవచ్చు. రంగులేని అనుఘటకాలను ఇతర కారకాలను చల్లడం వంటి ప్రయత్నాల ద్వారా గుర్తించవచ్చు.
ప్రశ్న 48.
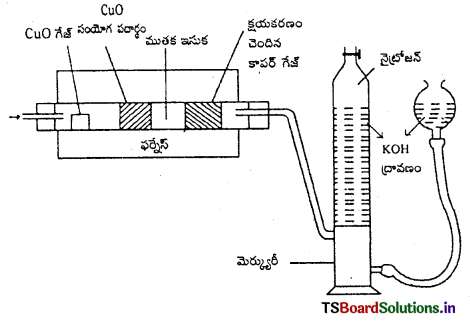
కర్బన సమ్మేళనంలో ఉన్న నైట్రోజన్ భార శాతాన్ని కింది విధానాలలో కనుక్కొనే పద్ధతిని రాయండి.
(a) డ్యూమాస్ పద్ధతి
(b) జెల్దాల్ పద్ధతి
జవాబు:
1. డ్యూమాస్ పద్ధతి : ఈ పద్ధతిలో తెలిసిన భారం ఉన్న కర్బన పదార్థానికి ముతక CuO కలిపి బాగా వేడి చేస్తారు. కార్బన్, హైడ్రోజన్లు CO2, H2O (ఆవిర్లు) గా ఆక్సీకరణం చెందుతాయి. నైట్రోజన్ N2 వాయువుగా మారుతుంది. కొంత నైట్రోజన్ ఆక్సైడ్లుగా మారినా, ఆ ఆక్సైడ్లను వేడిగా ఉన్న కాపర్ జాలకం, N2 వాయువుగా క్షయకరణం చెందిస్తుంది. ఉత్పన్న వాయువులను KOH ద్రావణం గుండా పంపుతారు. CO2 వాయువు KOH ద్రావణంలో శోషణం చెందుతుంది. KOH ద్రావణంపై చేరుకున్న N2 వాయువు ఘనపరిమాణాన్ని కొలుస్తారు.
గణన : గది ఉష్ణోగ్రత TK వద్ద గ్రా. ల సమ్మేళనం V మి.లీ. N2 వాయువును ఇచ్చినదని అనుకొనుము.
ప్రయోగ పరిస్థితులు
P1 = (P – p) మి. మీ
ఇచ్చట p = నీటి ఆవిరి పీడనం
T1 = TK
V1 = V మి.లీ.
STP పరిస్థితులు
P2 = 760 మి. మీ
T2 = 273 K
V2 = ?
T1 = TK
V1 = V మి.లీ.
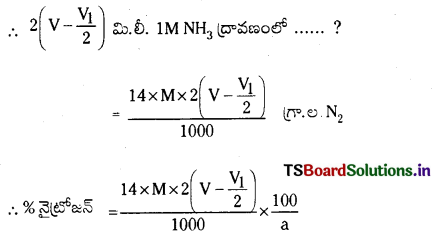
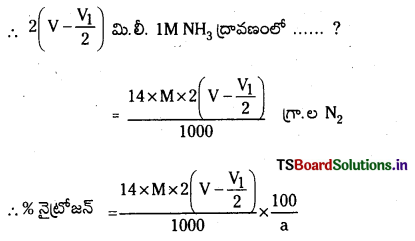
\(\frac{P_1 V_1}{T_1}\) = \(\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
∴ V2 = \(\frac{P_1 V_1 T_2}{P_2 T_1}\) = \(\frac{(\mathrm{P}-\mathrm{p}) \times \mathrm{V} \times 273}{760 \times \mathrm{T}}\) = x మి.లీ.
22400 మి.లీ. N2 వాయువు STP వద్ద 28 గ్రా. బరువు కలిగి ఉంటుంది
∴ x మి.లీ. N2 …….. ?
= \(\frac{x \times 28}{22400}\) గ్రా. ల. N2
2. జెల్దాల్ పద్ధతి : ఈ పద్ధతిలో తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని CuSO4 సమక్షంలో గాఢ H2SO4 తో వేడి చేస్తారు. అప్పుడు కర్బన సమ్మేళనంలోని నైట్రోజన్ అంతా పరిమాణాత్మకంగా అమ్మోనియం సల్ఫేటుగా మారుతుంది. ప్రయోగ పాత్రలోని అనుఘటకాలను వేరే పాత్రలోనికి మార్చి అధిక
NaOH ద్రావణంతో వేడి చేస్తారు. అమ్మోనియా వాయువు విడుదల అవుతుంది. ఈ అమ్మోనియా వాయువును తెలిసిన ఘ.ప. మరియు గాఢత గల అధిక గాఢ H2SO4 లోకి పంపి శోషణం చెందిస్తారు.
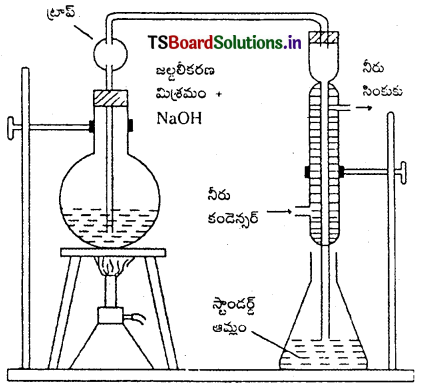
మిగిలిన ఆమ్లాన్ని ప్రమాణ క్షారంతో అంశమాపనం చేస్తారు. దీని నుండి అమ్మోనియాను తటస్థీకరించడానికి పట్టిన ఆమ్ల ప్రమాణాన్ని గణిస్తారు. దీని నుంచి ఎంత అమ్మోనియా ఏర్పడిందో గణించి దాని నుండి N2 భారశాతాన్ని లెక్కిస్తారు.
చర్యలు : కర్బన సమ్మేళనం + H2SO4 → (NH4)2SO4
(NH4)2SO4 + 2NaOH → Na2SO4 + 2H2O + 2NH3
2NH3 + H2SO4 + (NH4)2SO4
గణన : కర్బన సమ్మేళనం భారం = a గ్రా. మొదటిగా తీసుకున్న H2SO4 ఘ.ప. = V మి.లీ.
H2SO4 మొలారిటి = M, పూర్తి తటస్థీకరణానికి పట్టిన ఘ.ప. = V1 మి.లీ.
NaOH మొలారిటి = M
2NaOH + H2SO4 → Na2SO4 + 2H2O
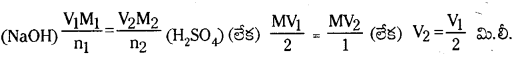
NH3 చేత తటస్థీకరించబడిన H2SO4 ఘ.ప. = (v – \(\frac{\mathrm{V}_1}{2}\)] మి.లీ.
= 2(V – \(\frac{V_1}{2}\))మి.లీ. NH3 ద్రావణం
1000 మి.లీ. 1M NH3 ద్రావణంలో 17 గ్రా. NH3 (లేదా) 14 గ్రా. N2 ఉన్నది.
![]()
ప్రశ్న 49.
ప్రేరేపక ప్రభావాన్ని ఒక ఉదాహరణ ఇచ్చి వివరించండి.
జవాబు:
CH3 – CH2 – CH2 – Cl అణువును తీసుకుంటే అందులో కార్బన్ – క్లోరిన్ పరమాణువుల మధ్య σ సమయోజనీయ బంధం ఉన్నది. అధిక ఋణ విద్యుదాత్మక Cl పరమాణువు ఎలక్ట్రాను తనవైపు ఎక్కువగా ఆకర్షిస్తుంది. దీనివల్ల ‘C’ పరమాణువు కంటె Cl పరమాణువు మీద ఋణ విద్యుదావేశ సాంద్రత ఎక్కువగా ఉంటుంది. ‘దీనిని ![]() (లేక)-C → Cl గా చూపిస్తారు. అయితే క్లోరిన్ బంధం ఏర్పరచిన కార్బన్ పరమాణువు తిరిగి వేరే కార్బన్తో ఏర్పరచి ఉండటం వల్ల ఈ ప్రభావం ఇతర కార్బన్ పరమాణువులకు కూడా ప్రసారం అవుతుంది.
(లేక)-C → Cl గా చూపిస్తారు. అయితే క్లోరిన్ బంధం ఏర్పరచిన కార్బన్ పరమాణువు తిరిగి వేరే కార్బన్తో ఏర్పరచి ఉండటం వల్ల ఈ ప్రభావం ఇతర కార్బన్ పరమాణువులకు కూడా ప్రసారం అవుతుంది.
![]()
క్లోరిన్ ఎలక్ట్రాన్ ఆకర్షణ ఫలితంగా C1 కార్బన్కు కొంత ఎలక్ట్రాన్ న్యూనత ఏర్పడుతుంది. దీనిని సరిచేసికోవడానికి C, తిరిగి C,C, సమయోజనీయ బంధంలోని ఎలక్ట్రాన్ జంటను తనవైపు ఆకర్షిస్తుంది. ఇప్పుడు C2 కార్బన్కు ఎలక్ట్రాన్ న్యూనత ఏర్పడుతుంది. అయితే ఈ ప్రభావం C1 – Cl మధ్యకంటే C1 – C2 మధ్య తక్కువ. ఈ ప్రభావం చాలా వేగంగా పడిపోతూ C3 తరువాత అతి తక్కువగా ఉండడం వల్ల గుర్తించదగ్గది కాదు. ఆ బంధాల ఎలక్ట్రాన్ పంపకంపై కనిపించే ఈ ప్రభావాన్ని ప్రేరేపక ప్రభావం అంటారు. ప్రేరేపక ప్రభావం, కార్బన్పై ఉన్న ప్రతిక్షేపకాల ఎలక్ట్రాన్ సాంద్రతను దానం చేసే లేదా ఆకర్షించే స్వభావంపై ఆధారపడి ఉంటుంది. ఈ స్వభావం ఆధారంగా ప్రతిక్షేపకాలను రెండు రకాలుగా వర్గీకరించారు. అవి
- ఎలక్ట్రాన్ ఆకర్షక గ్రూపులు
- ఎలక్ట్రాన్ దాన గ్రూపులు. ఎలక్ట్రాన్ దాన గ్రూపులు ధన ప్రేరక ప్రభావాన్ని, ఎలక్ట్రాన్ ఆకర్షక గ్రూపులు ఋణ ప్రేరక ప్రభావాన్ని చూపిస్తాయి.
ప్రేరక ప్రభావం రసాయన చర్యాశీలతల మీద మరియు భౌతిక ధర్మాల మీద ప్రభావాన్ని చూపిస్తుంది.
ప్రశ్న 50.
మీసోమరిక్ ప్రభావాన్ని వివరించండి.
జవాబు:
ఒక శృంఖలంలో సంయుగ్మ విధానంలో ఒక పరమాణువు లేదా గ్రూపు ఎలక్ట్రాన్ జంటలను స్థానభ్రంశం చేసే విధానాన్ని మీసోమరిక్ ప్రభావం అంటారు.
మీసోమరిక్ ప్రభావం ప్రధాన లక్షణాలు :
- ఇది స్థిరమైన ప్రభావం. అణువు భూస్థితిలో ఉన్నప్పుడు జరుగుతుంది.
- ఒంటరి జతలు, π ఎలక్ట్రాన్లతో సంయుగ్మ విధానంలో ఎలక్ట్రాన్ స్థానభ్రంశం జరుగుతుంది.
- ఇది భౌతిక ధర్మాన్ని, చర్యావేగాన్ని ప్రభావితం చేస్తుంది.
ఏ గ్రూపులైతే మిగిలిన అణుభాగంలో ఎలక్ట్రాన్ సాంద్రతను పెంచుతాయో వాటికి +M ప్రభావం ఉన్నదని అంటారు. ఆ గ్రూపులలో ఒంటరి ఎలక్ట్రాన్ జంట ఉంటుంది.

ప్రశ్న 51.
రెజోనెన్స్ ప్రభావాన్ని ఒక ఉదాహరణతో వివరించండి.
జవాబు:
ఒక అణువు ధర్మాలన్నింటిని కేవలం ఒక నిర్మాణంతో వివరించలేము. అటువంటి సందర్భంలో అణువుకు అనేక నిర్మాణాలు ఇవ్వవలసి వస్తుంది. ప్రతి ఒక్క నిర్మాణం అణువు యొక్క కొన్ని ధర్మాలను వివరిస్తుంది. అన్ని నిర్మాణాలు కలిసి అణువు యొక్క అన్ని ధర్మాలను వివరిస్తాయి. దీనినే రెజోనెన్స్ అంటారు. ఆ విధంగా అణువుకు ఊహించిన అన్ని నిర్మాణాలను రెజోనెన్స్ నిర్మాణాలు లేక కెనోనికల్ అంటారు.
రెజోనెన్స్ నిర్మాణాలకు ఉండవలసిన ముఖ్య లక్షణాలు :
- అవి దాని నుంచి ఇంకొకటిగా మార్చేందుకు వీలుగా ఉంటాయి.
- దీనిలో ఎలక్ట్రాన్ స్థానభ్రంశాలు తప్ప కేంద్రకాల స్థానాలలో ఎలాంటి మార్పులూ ఉండవు.
- అణువులోని పరమాణువులన్నీ ఒకే తలంలో ఉంటాయి.
- అన్ని నిర్మాణాలలోనూ, జత కూడిన లేక జతకూడని ఎలక్ట్రాన్ల సంఖ్య ఒకే విధంగా ఉండాలి.
- కెనోనికల్ నిర్మాణాలన్నింటికి సాధ్యమైనంత వరకూ దాదాపు సమానశక్తి ఉండాలి.
- రెజోనెన్స్ నిర్మాణం ఎంత ఎక్కువ స్థిరమైనదైతే అది అసలు నిర్మాణంలో అంత ఎక్కువగా పాల్గొంటుంది.
- ఎలక్ట్రాన్లు ఎంత ఎక్కువ అస్థానీకృతం చెందితే స్థిరత్వం అంత ఎక్కువగా ఉంటుంది.
- సమయోజనీయ బంధాలు ఎంత ఎక్కువగా ఉంటే ఆ నిర్మాణం అంతస్థిరమైనది.
రెజోనెన్స్ తం : పక్క పక్క పరమాణువుల మధ్య రెండు గా బంధాల లేదా ఒక 7 బంధం ఒక ఒంటరి జంటల మధ్య జరిగే అంతర చర్యల వల్ల ఉత్పన్నమయిన ధ్రువణాన్ని రెజోనెన్స్ ఫలితం అంటారు. ఈ ఫలితం శృంఖలం ద్వారా ప్రసారం అవుతుంది.
ఎలక్ట్రాన్ల బదలాయింపు ప్రతిక్షేపక పరమాణువు లేదా గ్రూపు నుండి అణువుపైకి సంయుగ్మ వ్యవస్థ ద్వారా జరిగితే దానిని (+R) తో సూచిస్తారు. అదే ఎలక్ట్రాన్ బదలాయింపు ప్రతిక్షేపక పరమాణువు లేక గ్రూపు వైపుకు అయితే దానిని (−R) తో సూచిస్తారు.
రెజోనెన్స్ శక్తి : అసలైన నిర్మాణం (రెజోనెన్స్ సంకర రూపం) శక్తికి, అత్యంత స్థిరమైన రెజోనెన్స్ నిర్మాణం శక్తికి మధ్య గల భేదాన్ని రెజోనెన్స్ శక్తి అంటారు.
ప్రశ్న 52.
కర్బన రసాయన చర్యలు ఎన్ని రకాలో వివరించండి.
జవాబు:
కర్బన రసాయన చర్యలు నాలుగు రకాలు. అవి
(1) సంకలన చర్యలు
(2) ప్రతిక్షేపణ చర్యలు
(3) విలోపన చర్యలు
(4) అణు పునరమరికలు.
1. సంకలన చర్యలు :*ఈ చర్యలలో క్రియాధారం, కారకం రెండూ కలసి ఉత్పన్నాన్ని ఇస్తాయి.
ఉదా :
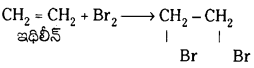
2. ప్రతిక్షేపణ చర్యలు : ఈ చర్యలలో ఒక పరమాణువు లేదా గ్రూపు క్రియాధారంలోని వేరే పరమాణువు లేదా గ్రూపును స్థానభ్రంశం చేసి క్రియాధారంతో బంధం ఏర్పరుస్తుంది.
ఉదా :
![]()
3. విలోపన చర్యలు : ఇచ్చట రెండు లేక అంతకంటె ఎక్కువ పరమాణువులు లేదా గ్రూపులు క్రియాధారం నుండి విలోపనం చెందుతాయి. దీనివల్ల ద్విబంధం (లేక) త్రిబంధం ఉత్పన్నంలో ఏర్పడతాయి.
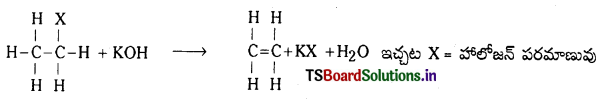
4. అణువుల పునరమరికలు : దీనిలో తక్కువ స్థిరత్వం గల ఒక కర్బన పదార్థం స్థిరత్వం గల వేరొక కర్బన పదార్థంగా పునరమరిక చెందుతాయి. దీనిలో ఒకస్థానం నుండి వేరొక స్థానానికి ఒక పరమాణువు లేదా సమూహం బదిలీ అయి వెళ్ళిపోతుంది.
ఉదా :
1)
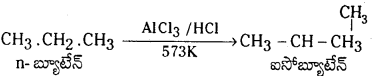
ఉదా :
2)
ప్రశ్న 53.
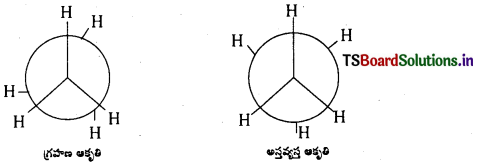
ఈథేన్ అనురూపకాలను రాసి వాటిలో దేనికి స్థిరత్వం ఎక్కువో తెలపండి.
జవాబు:
ఈథేన్ – అనురూపాత్మక సాదృశ్యములు : ఈథేన్ అణువులో ఒక కార్బన్ పరమాణువు స్థానమును స్థిరీకరించి రెండవ కార్బన్ పరమాణువును C – C బంధ అక్షముపై చక్ర భ్రమణము చేయుట వలన అనేక ప్రాదేశిక అమరికలు గల రూపములు లభించును. ఈ రూపములను అనురూపాత్మక సాదృశ్యములందురు. ఈథేన్ ప్రధాన అనురూపాత్మక సాదృశ్యములు.
1) గ్రహణ ఆకృతి
2) అస్తవ్యస్త ఆకృతి
అస్తవ్యస్త ఆకృతి (staggered form), గ్రహణ ఆకృతి (eclipsed form) కన్నా స్థిరమైనది. కారణం
గ్రహణ ఆకృతిలో రెండు కర్బన పరమాణువులపై గల హైడ్రోజన్ పరమాణువులు అతి సున్నితంగా ఉండుట వలన వీటి మధ్య వికర్షణ బలములు అధికము. కావున ఈ రూపమునకు స్థిరత్వము తక్కువ.
అస్తవ్యస్త ఆకృతిలో రెండు కర్బన పరమాణువులపై గల హైడ్రోజన్ పరమాణువులు వీలయినంత దూరంగా ఉండుటవలన, ఈ రూపములో వికర్షణ బలములు అతి స్వల్పము. కనుక శక్తి తక్కువ కావున దీనికి స్థిరత్వము అధికము.
ప్రశ్న 54.
బెంజీన్ యొక్క ఏరోమాటిక్ ఎలక్ట్రోఫిల్లిక్ ప్రతిక్షేపణ చర్యలను వివరించండి.
జవాబు:
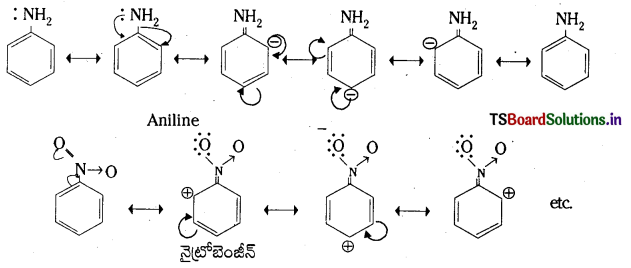
బెంజీన్ యొక్క ఏరోమాటిక్ ఎలక్ట్రోఫిల్లిక్ ప్రతిక్షేపణ చర్యా విధానము : బెంజీన్ యొక్క ఏరోమాటిక్ ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్య రెండు దశలలో జరుగుతుంది.
1. మొదటి దశలో ఎలక్ట్రోఫైల్ ఒక బెంజీన్ అణువులోని కార్బన్పై చర్య జరిపి కార్బోకాటయానన్ను ఏర్పరుస్తుంది. ఇది రెజోనెన్స్ ద్వారా స్థిరత్వం పొందుతుంది.
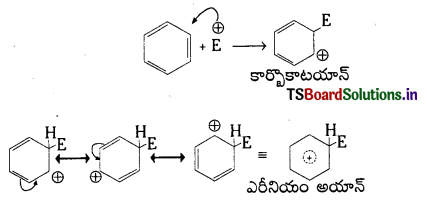
రెండవదశలో ఎరీనియం అయాన్ ఒక ప్రోటాన్ను కోల్పోతుంది.
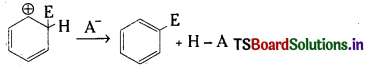
ప్రశ్న 55.
ఇథిలీన్ సంకలన చర్యలను (ఎలక్ట్రోఫిల్లిక్) చర్యాగతిని వివరించండి.
జవాబు:
ఇథిలీన్ ఎలక్ట్రోఫిల్లిక్ సంకలన చర్యా విధానము: ఇథిలీన్ C – C మధ్య ఉన్న ద్విబంధంలోని π – ఎలక్ట్రోఫైల్కు అందుబాటులో ఉంటాయి. ద్విబంధంపై ఎలక్ట్రోఫైల్ సంకలన చర్యలో రెండు క్రొత్త 6- ఏర్పడతాయి.
మొదటిదశ : ఇథిలీన్పై ఎలక్ట్రోఫైల్ చర్యలో కార్బోనియం అయాన్ ఏర్పడుతుంది.
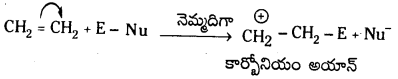
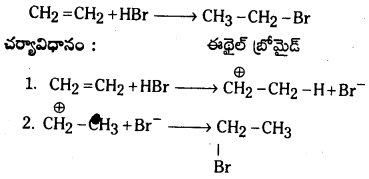
పై దశలో ఏర్పడిన కార్బోనియం అయాన్పై న్యూక్లియోఫైల్ (Nu) చర్యలలో అంతిమ ఉత్పన్నమేర్పడుతుంది.

ఉదా : ఇథిలీన్, HBr తో సంకలనం చెంది ఇథైల్ బ్రోమైడ్నస్తుంది.
ప్రశ్న 56.
చర్యా సంవిధానం (Mechanism of the reaction) ద్వారా ఆల్కేన్ స్వేచ్ఛా ప్రాతిపదిక హాలోజినేషన్ చర్యను వివరించండి.
జవాబు:
ఆల్కేన్ స్వేచ్ఛా \(\mathbf{A}^{\ominus}\) ప్రాతిపదిక హాలోజినేషన్ లేదా హాలోజనీకరణం : స్వేచ్ఛాప్రాతిపదికా విధానంలో క్లోరినీకరణ మూడు దశల్లో జరుగుతుంది.
1. శృంఖల చర్య ప్రారంభ చర్య : ఇక్కడ క్లోరిన్ అణువు శక్తిని గ్రహించి క్లోరిన్ స్వేచ్ఛా ప్రాతిపదికలుగా విడిపోతుంది.

2. శృంఖల చర్య వ్యాప్తి : పైన ఏర్పడిన క్లోరిన్ స్వేచ్ఛా ప్రాతిపదికలు ఈథేన్ అణువుతో చర్య జరుపుతాయి.
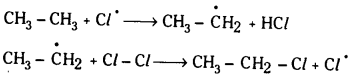
ఈ చర్యలు అనేక మార్లు పునరావృతమై చర్యను శృంఖల చర్యగా మారుస్తాయి. ఈ చర్యలను చర్యావ్యాప్తి చర్యలు అంటారు.
3. శృంఖల చర్యల ముగింపు : స్వేచ్ఛా ప్రాతిపదికలు నేరుగా కలిసిపోయి శృంఖల చర్యలు అంతమవుతాయి.
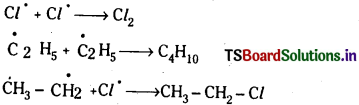
ప్రశ్న 57.
మార్కొనికాఫ్ నియమం, ఖరాష్ ప్రభావాల్ని వివరించండి.
జవాబు:
ప్రోపీన్తో HBr సంకలనం చెంది మార్కొనికాఫ్ నియమము ప్రకారం 2–బ్రోమో ప్రోపేన న్ను ఇస్తుంది. కాని బెంజాయిల్ పెరాక్సైడ్ సమక్షంలో ప్రోపీన్ క్కు HBrను కలిపితే 1-బ్రోమో ప్రోపేన్ ఏర్పడుతుంది. ఇక్కడ యాంటి మార్కొనికాఫ్ నియమము ప్రకారము సంకలనం జరుగుతుంది.
మార్కొనికాఫ్ నియమము : ఒక అసమకారకం ద్విబంధంలో సంకలనం చెందేటపుడు అసమకారకం రుణావేశ భాగం ద్విబంధంలో తక్కువ హైడ్రోజన్లున్న కార్బన్పై సంకలనం చెందుతుంది.
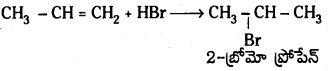
చర్యావిధానము (ఎలక్ట్రోఫిల్లిక్ సంకలన చర్య) :
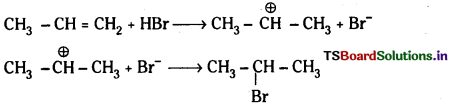
యాంటి మార్కొనికాఫ్ నియమము : ఒక అసమకారకం ద్విబంధంతో పెరాక్సైడ్ సమక్షంలో సంకలనం చెందేటపుడు అసమకారకం రుణావేశ భాగం ద్విబంధంలో ఎక్కువ హైడ్రోజన్లున్న కార్బన్పై సంకలనం చెందుతుంది. దీనినే ఖరాష్ ప్రభావం అని కూడా అంటారు. బెంజోయల్
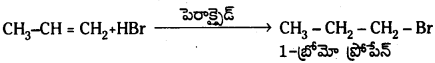
చర్యావిధానం (స్వేచ్ఛా ప్రాతిపదిక సంకలన చర్య) :
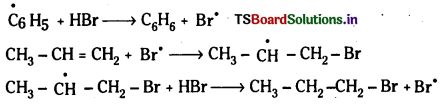
ప్రశ్న 58.
కింది సమ్మేళనాలను బెంజీన్ నుంచి ఎలా మార్చవచ్చు?
(a) క్లోరోబెంజీన్
(b) టోలీస్
(c) p–నైట్రోటోలీన్
జవాబు:
(a) క్లోరోబెంజీన్ : బెంజీన్ క్లోరిన్తో FeCl3 సమక్షంలో చర్య జరిపి క్లోరోబెంజీన్ ను ఏర్పరచవచ్చు.
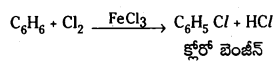
(b) టోలీస్ : బెంజీన్ ను CH3Cl తో Al Cl3 సమక్షంలో చర్య జరిపి టోలీన్ ను ఏర్పంచవచ్చు. (ఫీడల్ క్రాఫ్ట్ చర్య)
(c) P-నైట్రోటోలీన్ : బెంజీన్ నుంచి p – నైట్రో టోలీన్ ను ఈ క్రింది విధంగా తయారు చేయవచ్చు.
ప్రశ్న 59.
బేసి సంఖ్యలో కార్బన్లున్న ఆల్కేన్లను ఉర్ల చర్య ద్వారా ఎందుకు తయారుచేయలేరు? ఏదైనా ఉదాహరణతో వివరించండి.
జవాబు:
ఉర్వ్ చర్య : ఆల్కైల్ హాలైడ్ సోడియం లోహంతో పొడి ఈథర్ సమక్షంలో చర్య జరిపి ఆల్కేన్లను ఏర్పరచే చర్యను ఉర్ట్ చర్య అంటారు. R – X + 2Na + R – X→ R – R + 2NaX
ఉర్ట్ చర్యను బేసి సంఖ్యలో కార్బన్లు ఉన్న ఆల్కేన్లను తయారుచేయుటకు ఎక్కువగా ఉపయోగించరు. బేసి సంఖ్యలో కార్బన్లు ఉన్న ఆల్కేనులను తయారుచేయుటకు రెండు విభిన్నమైన ఆల్కైన్హాలైడ్లను తీసుకోవలెను. ఈ విధంగా తీసుకొనుట వలన ఏర్పడే ఉత్పన్నం మిశ్రమ రూపంలో ఉంటుంది. అంతేకాకుండా ఉత్పన్నం తక్కువ మొత్తంలో ఏర్పడుతుంది.
![]()
ప్రశ్న 60.
కర్బన సమ్మేళనాలలో నైట్రోజన్, సల్ఫర్, హాలోజన్లను గుణాత్మకంగా విశ్లేషించే సమీకరణాలను రాయండి.
జవాబు:
నైట్రోజన్ న్ను గుర్తించుట : కొద్దిగా లెసైన్ ద్రావణాన్ని పరీక్ష నాళికలో తీసికొని దానికి కొద్ది చుక్కలు NaOH ద్రావణం కలిపి క్షారీకృతం చేసి దానికి అపుడే తయారు చేసిన ఫెర్రస్ సల్ఫేట్ ద్రావణాన్ని కలుపుతారు. దీనికి 2 లేక 3 చుక్కలు FeCl, ద్రావణం కలిపి చల్లబరిచి గాఢ HCl ద్రావణంతో ఆమ్లీకృతం చేస్తారు. ప్రశ్యన బ్లూ లేదా ఆకుపచ్చని రంగు లేదా అవక్షేపం వస్తే నైట్రోజన్ ఉన్నట్లుగా గుర్తించాలి.
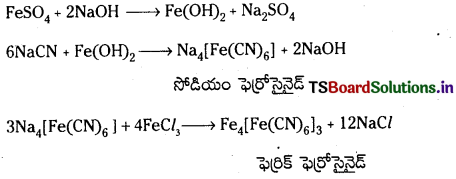
సల్ఫర్ను గుర్తించుట : కొద్దిగా లెసైన్ ద్రావణాన్ని పరీక్ష నాళికలో తీసికుని దానికి తాజాగా తయారు చేసిన సోడియం నైట్రోపృసైడ్ ద్రావణం కలపాలి. ముదురు ఊదా రంగు వస్తుంది. సల్ఫర్ ఉన్నట్లుగా గుర్తించాలి.
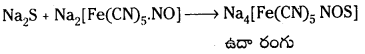
హాలోజన్లను గుర్తించుట : కొద్దిగా లెసైన్ ద్రావణాన్ని పరీక్ష నాళికలో తీసికొని నత్రికామ్లంతో ఆమ్లీకృతం చేసి AgNO, “ద్రావణాన్ని కలపాలి.
Ag+ + X– → AgX
తెల్లని అవక్షేపం ఏర్పడి అది NH4 OH ద్రావణంలో కరిగితే ఆ హాలైడ్ Cl– లేత పసుపుపచ్చ అవక్షేపం ఏర్పడి అది NH4 OH లో పాక్షికంగా కరిగితే ఆ హాలైడ్ Br పసుపు పచ్చ అవక్షేపం ఏర్పడి అది NH4 OH లో కరగకపోతే ఆ హాలైడ్ I–.
ప్రశ్న 61.
కర్బన సమ్మేళనంలో కార్బన్, హైడ్రోజన్ల భారశాతాన్ని కనుక్కోవడానికి అనువైన సమీకరణాలను రాయండి.
జవాబు:
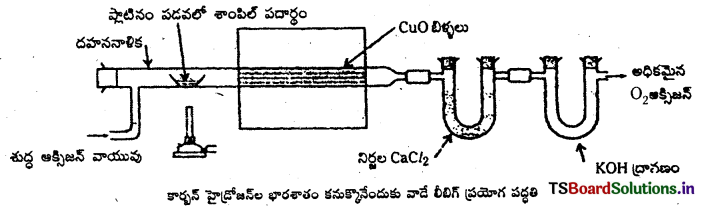
తెలిసిన భారం గల కర్బన పదార్థానికి CuO ను కలిపి ఆ మిశ్రమాన్ని దహన నాళికలో తీసికొని అధికమైన గాలి సమక్షంలో పూర్తిగా దహనం చెందిస్తారు. అపుడు కర్బన పదార్థంలోని కార్బన్ CO2 గానూ, హైడ్రోజన్ H2O గానూ మారతాయి. ఆ విధంగా లభించిన CO2, H2O లను ముందుగా తూచిన నిర్జల CaCl2, కాస్టిక్ పొటాష్లతో ఉన్న విడివిడి U – గొట్టాలలోకి పంపుతారు. CaCl2 గొట్టంలో పెరిగిన బరువు వెలువడిన నీటి ఆవిరి బరువుగానూ, కాస్టిక్ పొటాష్ గొట్టంలో పెరిగిన బరువు వెలువడిన CO2 భారంగానూ గుర్తించాలి.
గణన :’ ‘a’ గ్రా.ల కర్బన సమ్మేళనాన్ని దహనం చెందిస్తే ‘b’ గ్రా. ల నీటి ఆవిరి, ‘c’ గ్రా.ల CO2 వచ్చాయి అనుకోండి.
కార్బన్ భారశాతం :
44 గ్రా. CO2 లో 12 గ్రా. ‘C’ ఉన్నది.
∴ c గ్రా.ల C2O …………?
= \(\frac{12 \times C}{44}\) గ్రా. కార్బన్
‘a’ గ్రా.ల కర్బన సమ్మేళనంలో \(\frac{12 \times c}{44}\)-గ్రా. కార్బన్ ఉన్నది.
∴ 100 గ్రా.ల కర్బన సమ్మేళనంలో ………… ?
∴ కార్బన్ భారశాతం = \(\frac{100 \times 12 \times \mathrm{c}}{44 \times \mathrm{a}}\) గ్రా.ల కార్బన్
హైడ్రోజన్ భారశాతం :
18 గ్రా. H2O లో 12 గ్రా. ‘H’ ఉన్నది.
∴ b గ్రా.ల H2O ……..
= \(\frac{2 \times b}{18}\) గ్రా. ‘H’
‘a’ గ్రా.ల కర్బన సమ్మేళనంలో \(\frac{2 \times b}{18}\) గ్రా. ‘H’ ఉన్నది.
∴ 100 గ్రా.ల కర్బన సమ్మేళనంలో…… 2
∴ ‘H’ భారశాతం = \(\frac{100 \times 2 \times b}{18 \times a}\) గ్రా.ల ‘H’
ప్రశ్న 62.
నైట్రోజన్ భారశాతాన్ని డ్యూమాస్, జెల్దాల్ పద్ధతిలో కనుక్కొనే విధానాన్ని వివరించండి.
జవాబు:
1. డ్యూమాస్ పద్ధతి : ఈ పద్ధతిలో తెలిసిన భారం ఉన్న కర్బన పదార్థానికి ముతక CuO కలిపి బాగా వేడి చేస్తారు. కార్బన్ హైడ్రోజన్లు CO2, H2O (ఆవిర్లు) గా ఆక్సీకరణం చెందుతాయి. నైట్రోజన్ N2 వాయువుగా మారుతుంది. కొంత నైట్రోజన్ ఆక్సైడ్లుగా మారినా, ఆ ఆక్సైడ్లను వేడిగా ఉన్న కాపర్ జాలకం, N2 వాయువుగా క్షయకరణం చెందిస్తుంది. ఉత్పన్న వాయువులను KOH ద్రావణం గుండా పంపుతారు. CO2 వాయువు KOH ద్రావణంలో శోషణం చెందుతుంది. KOH ద్రావణంపై చేరుకున్న N2 వాయువు ఘనపరిమాణాన్ని కొలుస్తారు.
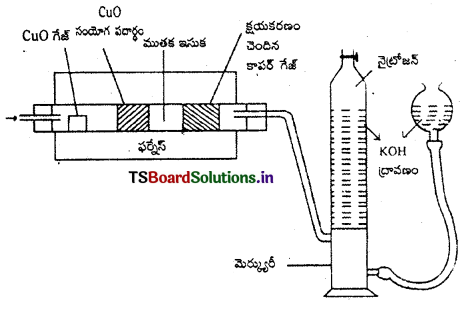
గణన : గది ఉష్ణోగ్రత TK వద్ద a గ్రా.ల సమ్మేళనం V మి.లీ. N2 వాయువును ఇచ్చినదని అనుకొనుము.
ప్రయోగ పరిస్థితులు
P1 = (P-p) మి . మీ
ఇచ్చట p = నీటి ఆవిరి పీడనం
T1 = TK
V1 = V మి.లీ.
STP పరిస్థితులు
P2 = 760 మి.మీ.
T2 = 273 K
V2 = ?
T1 = TK
V1 = V మి.లీ.
\(\frac{P_1 V_1}{T_1}\) = \(\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
∴ V2 = \(\frac{P_1 V_1 T_2}{P_2 T_1}\) = \(\frac{(P-p) \times V \times 273}{760 \times T}\) = xమి.లీ.
22,400 మి.లీ. N2 వాయువు STP వద్ద 28 గ్రా. బరువు కలిగి ఉంటుంది.
∴ x మి.లీ. N2 ……… ?
= \(\frac{x \times 28}{22400}\) గ్రా.లు.
‘a’ గ్రా.ల పదార్థం ………. \(\frac{28 \times x}{22400}\) గ్రా. N2 కలిగి ఉన్నది.
∴ 100 గ్రా.ల పదార్థం …… ?
= \(\frac{100}{\mathrm{a}} \times \frac{28 \times \mathrm{x}}{22400}\) గ్రా.ల. N2
2. జెల్దాల్ పద్ధతి : ఈ పద్ధతిలో తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని CuSO4 సమక్షంలో గాఢ H2SO4 తో వేడి చేస్తారు. అప్పుడు కర్బన సమ్మేళనంలోని నైట్రోజన్ అంతా పరిమాణాత్మకంగా అమ్మోనియం సల్ఫేటుగా మారుతుంది. ప్రయోగ పాత్రలోని అనుఘటకాలను వేరే పాత్రలోనికి మార్చి అధిక NaOH ద్రావణంతో వేడి చేస్తారు. అమ్మోనియా . వాయువు విడుదల అవుతుంది. ఈ అమ్మోనియా వాయువును తెలిసిన ఘ.ప. మరియు గాఢత గల అధిక గాఢ H2SO4 లోకి పంపి శోషణం చెందిస్తారు. మిగిలిన ఆమ్లాన్ని ప్రమాణ క్షారంతో అంశమాపనం చేస్తారు.
దీని నుండి అమ్మోనియాను తటస్థీకరించడానికి పట్టిన ఆమ్ల ప్రమాణాన్ని గణిస్తారు. దీని నుంచి ఎంత అమ్మోనియా ఏర్పడిందో గణించి దాని నుండి N2 భారశాతాన్ని లెక్కిస్తారు.
చర్యలు : కర్బన సమ్మేళనం + H2SO4 → (NH4)2SO4
(NH4)2SO4 + 2NaOH → Na2SO4 + 2H2O + 2NH3
2NH3 + H2SO4 → (NH4)2SO4
గణన : కర్బన సమ్మేళనం భారం = a గ్రా. మొదటిగా తీసుకున్న H2SO4 ఘ.ప. = V మి.లీ.
H2SO4 మొలారిటి = M, పూర్తి తటస్థీకరణానికి పట్టిన ఘ.ప. = V1 మి.లీ.
NaOH మొలారిటి = M
2NaOH + H2SO4 → Na2SO4 + 2H2O
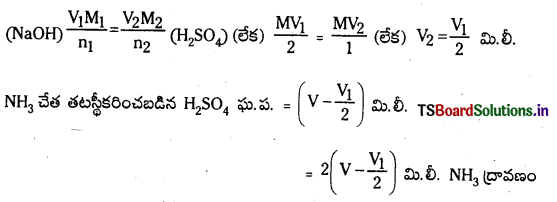
1000 మి.లీ. 1M NH3 ద్రావణంలో 17 గ్రా. NH3 (లేదా) 14 గ్రా. N2 ఉన్నది.
![]()
ప్రశ్న 63.
కర్బన సమ్మేళనంలోని సల్ఫర్, ఫాస్ఫరస్, ఆక్సిజన్ల పరిమాణాత్మక విశ్లేషణను వివరించండి.
జవాబు:
కర్బన సమ్మేళనంలోని ఫాస్ఫరస్ భారశాతం కనుక్కొనుట : ఫాస్ఫరస్ భారశాతాన్ని కనుక్కోవడానికి తెలిసిన ద్రవ్యరాశి గల కర్బన పదార్థాన్ని సధూమ నైట్రికామ్లంలో వేడి చేయాలి. ఫాస్ఫరస్ ఫాస్ఫారిక్ ఆమ్లంగా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లానికి అమ్మోనియా, అమ్మోనియం మోలిబేట్ ద్రావణాలు కలిపి అమ్మోనియం ఫాస్ఫో మోలిబేట్
[(NH4)3 PO4.12M0O3]గా అవక్షేపించాలి.
కర్బన సమ్మేళనం ద్రవ్యరాశి = mg
అమ్మోనియం ఫాస్ఫోమోలిబ్బేడ్ = m1g
(NH4)3 PO4 . 12 MoO3 అణు ద్రవ్యరాశి = 1877g
ఫాస్ఫరస్ భారశాతం = \(\frac{31 \times \mathrm{m}_1 \times 100}{1877 \times \mathrm{m}}\)
కర్బన సమ్మేళనంలోని సల్ఫర్ భారశాతం కనుక్కొనుట కర్బన సమ్మేళనంలోని సల్ఫర్ భారశాతం కనుక్కోవడానికి తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని సోడియం పెరాక్సైడ్ లేదా సధూమ నైట్రికామ్లంతో కేరియస్ నాళికలో వేడిచేస్తారు. సమ్మేళనంలోని సల్ఫర్ H2SO4 గా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లాన్ని అధికంగా జల బేరియం క్లోరైడ్ ద్రావణం కలిపి బేరియం సల్ఫేట్గా అవక్షేపింప చేస్తారు. ఈ అవక్షేపాన్ని వడపోత ద్వారా వేరుచేసి, కడిగి, పొడి చేసి ‘భారాన్ని కనుక్కొంటారు.
తీసుకున్న కర్బన పదార్థ భారం = mg
ఏర్పడిన బేరియం సల్ఫేట్ భారం = m1g
m1, g ల బేరియం సల్ఫేట్లోని సల్ఫర్ = \(\frac{32 \times \mathrm{m}_1}{233}\)g
(1 మోల్ BaSO4 = 233gm BaSO4 = 32 gm సల్ఫర్)
సల్ఫర్ భారశాతం = \(\frac{32 \times m_1 \times 100}{233 \times m}\)
ఆక్సిజన్ పరిమాణాత్మక విశ్లేషణ : తెలిసిన ద్రవ్యరాశి గల కర్బన సమ్మేళనాన్ని నైట్రోజన్ వాయువు సమక్షంలో వేడిచేస్తారు. వెలువడిన ఉత్పన్న ఆక్సైడ్ వాయువుల మిశ్రమాన్ని ఎర్రటి వేడి బొగ్గు పైకి పంపి మొత్తం ఆక్సైడ్లలో ఉన్న ఆక్సిజన్ను CO గా మారుస్తారు. ఆ తరువాత మిశ్రమ వాయువులను వేడిగా ఉన్న I2O5 మీదుగా పంపుతారు. అపుడు CO తిరిగి CO2 గా మారుతుంది. అయొడిన్ వెలువడుతుంది.
కర్బన సమ్మేళన భారం = a g
CO2 భారం = b g
44 g CO2 లో 32 g O2 ఉన్నది.
∴ b g CO2 …. ?
a g పదార్ధంలో \(\frac{\mathrm{b} \times 32}{44}\) g O2 ఉంటే
100 g పదార్థంలో O2 భారం శాతం = \(\frac{100 \times \mathrm{b} \times 32}{44 \times \mathrm{a}}\)g O2.
ప్రశ్న 64.
కేరియస్ పద్ధతిలో జరిపే కర్బన సమ్మేళనంలోని హాలోజన్ ను పరిమాణాత్మక విశ్లేషణ వివరించండి.
జవాబు:
కేరియస్ పద్ధతిలో హాలోజన్ల పరిమాణాత్మక విశ్లేషణ : ఈ పద్ధతిలో తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని సధూమ HNO3 తో AgNO3 సమక్షంలో ఒక ప్రత్యేకమైన బలమైన గాజు నాళికలో వేడి చేస్తారు. అప్పుడు సమ్మేళనంలోని C, H లు CO2, H2O లుగా ఆక్సీకరణం చెందుతాయి. హాలోజన్లు సిల్వర్ హాలైడ్లుగా మారతాయి. సిల్వర్ హాలైడ్లను వడపోత ద్వారా వేరుచేసి, కడిగి, పొడిగా చేసి భారం కనుక్కొంటారు.
గణన : కర్బన సమ్మేళన భారం = a g
సిల్వర్ హాలైడ్ భారం = b g
1 మోల్ AgX లో 1 మోల్ X ఉన్నది.
∴ b g e AgX లో హాలోజన్ ….. ?
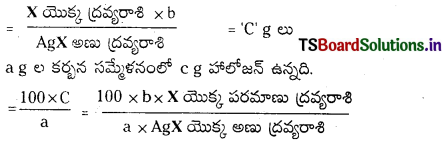
ప్రశ్న 65.
కార్సినోజెనిసిటీ అంటే ఏమిటి? రెండు ఉదాహరణలతో వివరించండి.
జవాబు:
బెంజీన్, ఇంకా అనేక బహుకేంద్రక వలయాల హైడ్రోకార్బన్లు విషపదార్థాలే కాక క్యాన్సర్ కారకాలు. వాటిలో ఎక్కువ పదార్థాలు పొగాకు, పెట్రోలియం, బొగ్గు వంటి కర్బన పదార్థాలు పూర్తిగా దహనం చెందకుంటే ఏర్పడతాయి. ఇవి మానవ శరీరాల్లో అనేక రసాయన చర్యలకు లోనై DNA ను నాశనం చేసి క్యాన్సర్ను కలుగజేస్తాయి. దీనినే కార్సినోజెనిసిటీ అంటారు.
ఉదా :