Telangana TSBIE TS Inter 1st Year Chemistry Study Material 9th Lesson S బ్లాక్ మూలకాలు Textbook Questions and Answers.
TS Inter 1st Year Chemistry Study Material 9th Lesson S బ్లాక్ మూలకాలు
అత్యంత లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ఆవర్తన పట్టికలో కర్ణ సంబంధం ఉండటానికి గల కారణాలను తెలపండి.
జవాబు:
ఆవర్తన పట్టికలో Li – Mg, Be – Al, B – Si ల మధ్య కర్ణ సంబంధం ఉంటుంది. దీనికి కారణం
- మూలక పరమాణు పరిమాణం సమానంగా ఉండటం.
- వాటి ఋణవిద్యుదాత్మకత విలువలు సమానంగా ఉండటం.
- మూలకాలకు ఒకే ద్రువణ సామర్ధ్యం (ఆవేశం / వ్యాసార్థాల నిష్పత్తి) ఉండటం.
ప్రశ్న 2.
K, Rb ల ఎలక్ట్రాన్ విన్యాసాలను పూర్తిగా రాయండి.
జవాబు:
ఎలక్ట్రాన్ విన్యాసాలు
K (Z = 19) – 1s2 2s2 2p6 3s2 3p6 4s1
Rb (Z = 37) – 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1
![]()
ప్రశ్న 3.
లిథియమ్ లవణాలు చాలావరకు ఆర్ద్రీకృతమై ఉంటాయి. ఎందుకు ?
జవాబు:
Li– అయాన్ యొక్క పరమాణు పరిమాణం తక్కువ మరియు హైడ్రేషన్ తీవ్రత ఎక్కువ. కావున Li లవణాలు చాలా వరకు ఆర్ద్రీకృతమై ఉంటాయి. ఉదా : LiCl 2H2O
ప్రశ్న 4.
క్షారలోహాలలో దేనికి అసాధారణ సాంద్రత ఉంటుంది ? గ్రూపు 1 మూలకాల సాంద్రతల మార్పులో క్రమం ఏమిటి ?
జవాబు:
‘K’ మూలకానికి అసాధారణ సాంద్రత ఉంటుంది. దీని సాంద్రత Na కన్నా తక్కువ ఉంటుంది. K యొక్క స్ఫటిక జాలకంలో అంతర పరమాణుక దూరాలు ఎక్కువగా ఉంటాయి.
IA group మూలకాల సాంద్రత క్రమం పెరుగుతుంది. అంటే Li < Na > K < Rb < Cs
ప్రశ్న 5.
సోడియమ్ కంటే లిథియమ్ నీటితో జరిపే చర్యాతీక్షణత తక్కువ. కారణాలను తెలపండి.
జవాబు:
లిథియమ్కు పరమాణు పరిమాణం తక్కువ మరియు హైడ్రేషన్ శక్తి ఎక్కువ. కావున Na కంటె Li నీటితో జరిపే చర్యా తీక్షణత తక్కువ.
ప్రశ్న 6.
క్షారలోహాల హాలైడ్లలో లిథియమ్ అయొడైడ్ అత్యధిక కోవలెంట్ ధర్మం కలది. కారణాలను తెలపండి.
జవాబు:
క్షారలోహాల హాలైడ్లలో లిథియమ్ అయొడైడ్ అత్యధిక కోవలెంట్ ధర్మం కలది. కారణం
- Li+ కు పరమాణు పరిమాణం తక్కువ.
- Li+కు ద్రువణతా సామర్థ్యం ఎక్కువ.
- I– అయాన్ యొక్క పరిమాణం మిగిలిన హాలైడ్ అయాన్ల పరిమాణం కన్నా ఎక్కువ ఉండటం వలన దీనికి విస్తారం చేయు సామర్థ్యం ఎక్కువ.
ప్రశ్న 7.
క్షారలోహ హైడ్రోజన్ కార్బొనేట్ కంటే లిథియమ్ హైడ్రోజన్ కార్బొనేట్ ఏ విధంగా విభేదిస్తుంది ?
జవాబు:
లిథియమ్ హైడ్రోజన్ కార్బొనేట్ ఘనరూపంలో లభ్యం కాదు. కాని మిగిలిన క్షారలోహ హైడ్రోజన్ కార్బొనేట్లు ఘన పదార్థాలుగా ఏర్పడతాయి.
ప్రశ్న 8.
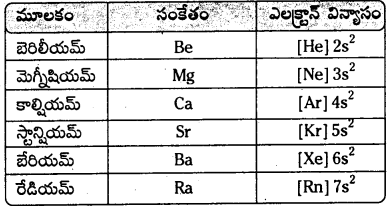
ఏవైనా రెండు క్షారమృత్తిక లోహాల ఎలక్ట్రానిక్ విన్యాసాలను పూర్తిగా రాయండి.
జవాబు:
Be(Z = 4) – 1s2 2s2
Mg (Z = 12) – 1s2 2s2 2p6 3s2
Ca (Z = 20) – 1s2 2s2 2p6 3s2 3p6 4s2
ప్రశ్న 9.
క్షారమృత్తిక లోహాల ద్రవీభవన, బాష్పీభవన స్థానాల మార్పుల గురించి చెప్పండి.
జవాబు:
క్షార మృతిక లోహ పరమాణువులు తక్కువ అయనీకరణ శక్తి కలిగి ఉండటం వల్ల వీటి ద్రవీభవన, బాష్పీభవన స్థానాలు సరైన క్రమంలో ఉండవు.
![]()
ప్రశ్న 10.
గ్రూపు 2 మూలకాలు జ్వాలకు కలిగించే స్వాభావిక రంగులు ఏమిటి ?
జవాబు:
గ్రూపు 2 మూలకాలు జ్వాలకు కలిగించే స్వాభావిక రంగులు
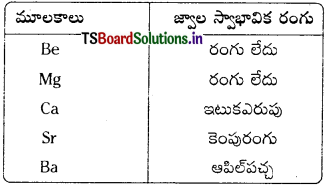
ప్రశ్న 11.
మెగ్నీషియమ్ లోహాన్ని గాలిలో మండిస్తే ఏం జరుగుతుంది ?
జవాబు:
Mg లోహాన్ని గాలిలో మండిస్తే కాంతివంతంగా మండి MgO మరియు Mg3N3 లను ఏర్పరచును.
2Mg + O2 → 2Mgo (మెగ్నీషియం ఆక్సైడ్)
3Mg + N2 → Mg3N2 (మెగ్నీషియం నైట్రైడ్)
ప్రశ్న 12.
లిథియమ్ కార్బొనేటికి మిగిలిన క్షారలోహాల కార్బొనేట్ల వలె ఉష్ణ స్థిరత్వం లేదు. వివరించండి.
జవాబు:
Li కు పరమాణు పరిమాణం తక్కువ మరియు ధృవణ సామర్థ్యం ఎక్కువ. కావున Li2CO3 తొందరగా విఘటనం చెంది స్థిరమైన Li2O మరియు CO2 లను ఏర్పరచును. కావున లిథియమ్ కార్బొనేట్కు మిగిలిన క్షారలోహాల కార్బొనేట్ల వలె ఉష్ణ స్థిరత్వం లేదు. Li2CO3 → Li2O + CO2
ప్రశ్న 13.
గ్రూపు 2 లోహాలు ద్రవ అమ్మోనియాలో అమ్మోనియేటెడ్ లోహ అయాన్లు ఏర్పడటానికి తుల్య సమీకరణాన్ని రాయండి.
జవాబు:
M + (x + y) NH3 → [M(NH3)x]2+ + 2 [e(NH3)y]–
ప్రశ్న 14.
క్షారమృత్తిక లోహాల ఫ్లోరైడ్లు నీటిలో ఆయా క్లోరైడ్ కంటే అల్ప ద్రావణీయత కలిగి ఉన్నవి. ఎందుకు ?
జవాబు:
ఫ్లోరైడ్ అయాన్ యొక్క పరిమాణం తక్కువ మరియు జాలక శక్తి ఎక్కువ. కావున క్షారమృత్తిక లోహాల ఫ్లోరైడ్లు నీటిలో ఆయా క్లోరైడ్ కంటే అల్ప ద్రావణీయత కలిగి ఉన్నవి.
ప్రశ్న 15.
ఆర్ద్ర Mg(NO3)2 ని వేడిచేస్తే ఏమౌతుంది ? దానికి తుల్య సమీకరణాన్ని ఇవ్వండి.
జవాబు:
ఆర్ద్ర Mg(NO3)2 లవణాన్ని వేడిచేయగా మొదట అనార్ద్ర Mg(NO3)2 ఏర్పడుతుంది. దీనిని తిరిగి వేడిచేస్తే ఆక్సైడ్ ఏర్పడుతుంది.
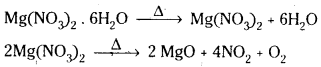
ప్రశ్న 16.
క్షారమృత్తిక లోహ హైడ్రాక్సైడ్ జల ద్రావణీయత గ్రూపులో పైనుంచి కిందికి పెరుగుతుంది. ఎందుకో చెప్పండి.
జవాబు:
క్షార మృత్తిక లోహ గ్రూపులో (IIA) పై నుండి క్రిందకుపోయే కొలది సాధ్రీకరణోష్ణం కంటే స్ఫటిక జాలక శక్తి అధికంగా తగ్గడం వల్ల వీటి హైడ్రాక్సైడ్ జల ద్రావణీయత క్రమంగా పెరుగుతుంది.
ప్రశ్న 17.
క్షారమృత్తిక లోహాల కార్బొనేట్ల, సల్ఫేట్ల జలద్రావణీయత గ్రూపులో కిందికి పోయినకొద్దీ ఎందుకు తగ్గుతుంది?
జవాబు:
గ్రూపులో పై నుంచి క్రిందకు పరమాణు పరిమాణం పెరుగుతుంది. కావున కార్బొనేట్, సల్ఫేట్ల యొక్క జాలక మరియు హైడ్రేషన్ ఎంథాల్పీలు తగ్గుతాయి. హైడ్రేషన్ ఎంథాల్పీలో తగ్గుదల జాలక ఎంథాల్పీలో తగ్గుదల కన్నా ఎక్కువగా ఉంటుంది. కావున క్షార మృత్తిక లోహాల కార్బొనేట్ల, సల్ఫేట్ల జలద్రావణీయత పై నుంచి క్రిందకు తగ్గుతాయి.
ప్రశ్న 18.
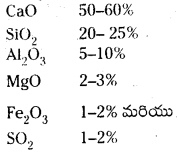
పోర్ట్లాండ్ సిమెంట్ సగటు సంఘటనాన్ని తెలపండి.
జవాబు:
పోర్ట్లాండ్ సిమెంట్ సంఘటనం :
ప్రశ్న 19.
సిమెంట్కి జిప్సమ్ని ఎందుకు కలుపుతారు ?
జవాబు:
సిమెంట్కు జిప్సమ్ కలుపుట వలన సెట్టింగ్ నెమ్మదిగా జరిగి సిమెంట్ తగినంతగా గట్టిపడుతుంది.
ప్రశ్న 20.
ప్రకృతిలో క్షారలోహాలు స్వేచ్ఛా స్థితిలో ఎందుకు దొరకవు ? (March 2013)
జవాబు:
క్షారలోహాలు చాలా చురుకైనవి. అందుచేత అవి స్వేచ్ఛా స్థితిలో దొరకవు. ఎప్పుడూ సంయోగస్థితిలోనే దొరుకుతాయి. Na మరియు K లు విస్తారంగా దొరికే క్షారలోహాలు.
ప్రశ్న 21.
సాల్వే పద్ధతిలో పొటాషియమ్ కార్బొనేట్ని తయారుచేయలేం. ఎందుకు ?
జవాబు:
అమ్మోనియం బై కార్బొనేట్ను సంతృప్త KCl కలిపితే KHCO3 అవక్షేపం ఏర్పడుతుంది. కాని అట్లేర్పడ్డ KHCO3 అధిక ద్రావణీయత కలిగి ఉంటుంది. కావున పొటాషియమ్ కార్బొనేట్ను సాల్వే పద్దతిలో తయారు చేయలేము.
ప్రశ్న 22.
కాస్టిక్ సోడా ముఖ్యమైన ఉపయోగాలను వివరించండి.
జవాబు:
కాస్టిక్ సోడా యొక్క ఉపయోగాలు
- సబ్బు, కాగితం, కృత్రిమ సిల్క్ మరియు అనేక రసాయన పదార్థాల భారీ తయారీల్లో ఉపయోగిస్తారు.
- పెట్రోలియం శుద్ధి చేయడంలో ఉపయోగిస్తారు.
- బాక్సెట్ను శుద్ధి చేయడంలో ఉపయోగిస్తారు.
- శుద్ధ కొవ్వులను, నూనెలను తయారుచేయటానికి ఉపయోగిస్తారు.
- ప్రయోగశాలలో కారకంగా ఉపయోగిస్తారు.
ప్రశ్న 23.
సోడియమ్ కార్బొనేట్ ముఖ్య ఉపయోగాలను వివరించండి.
జవాబు:
సోడియమ్ కార్బొనేట్ ముఖ్య ఉపయోగాలు
- మృదుజలాన్ని తయారుచేయటానికి, నేలను శుభ్రపరచటానికి Na2CO3 ను వాడతారు.
- లాండ్రీలలో Na2CO3 ను వాడతారు.
- గాజు, సబ్బు, బొరాక్స్. కాస్టిక్ సోడాల తయారీలో వాడతారు.
- కాగితం, రంగులు, వస్త్ర పరిశ్రమలలో వాడతారు.
![]()
ప్రశ్న 24.
పొడిసున్నం ముఖ్య ఉపయోగాలను వివరించండి.
జవాబు:
పొడిసున్నం ఉపయోగాలు
- చక్కెరను శుద్ధి చేయుటలో ఉపయోగిస్తారు.
- రంజన ద్రవ్యాలను తయారుచేయటంలో వాడతారు.
- సిమెంట్ తయారీలో వాడతారు.
- Na2CO3, NaOH ల తయారీలో ఉపయోగిస్తారు.
ప్రశ్న 25.
(i) BeCl2 (బాష్పం)
(ii) BeCl2 (ఘనపదార్థం) ల నిర్మాణాలను గీయండి.
జవాబు:
i) BeCl2 (బాష్పం) 1200K వద్ద రేఖీయ రూపంలో ఉండును.
Cl – Be – Cl
ii) ఘనస్థితిలో BeCl2 శృంఖల నిర్మాణం కలిగి ఉండును.
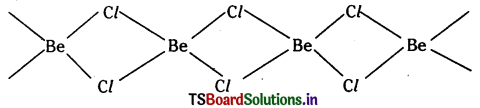
ప్రశ్న 26.
ప్లాస్టర్ ఆఫ్ పారిస్ ప్రాముఖ్యతను వివరించండి.
జవాబు:
- ప్లాస్టర్ ఆఫ్ పారిస్ని గృహ నిర్మాణాల్లోను, ప్లాస్టర్లోను ఉపయోగిస్తారు.
- ఎముకలు విరిగినా, నొప్పులు పట్టినా శరీర అవయవాలను కదలిక లేకుండా చేయడానికి దీనిని వాడతారు.
- దంత వైద్యంలో దీనిని వాడతారు.
![]()
ప్రశ్న 27.
క్షారమృత్తిక లోహాల కార్బొనేట్లలో దేనికి అధిక ఉష్ణ స్థిరత్వం ఉంటుంది ? ఎందుకు ?
జవాబు:
క్షారమృత్తిక లోహాల కార్బొనేట్లలో BaCO3 కు అధిక ఉష్ణస్థిరత్వం ఉంటుంది. కారణం Ba+2 అయాన్ యొక్క పరిమాణం ఎక్కువ కావటం వలన ద్రువణ సామర్థ్యం తక్కువగా ఉంటుంది. అందువలన BaCO3 త్వరగా విఘటనం చెందదు. కావున BaCO3 కు ఉష్ణస్థిరత్వం ఎక్కువగా ఉంటుంది.
ప్రశ్న 28.
కింది చర్యలకు తుల్య సమీకరణాలను రాయండి.
i) Na2O2 నీరు రసాయన చర్య
ii) నీటితో K2O చర్య
జవాబు:
i) Na2O2 + 2H2O → 2 NaOH + H2O2
ii) K2O + H2O → 2KOH
లఘు సమాధాన ప్రశ్నలు
ప్రశ్న 29.
ఆక్సీకరణ జ్వాలకు క్షారలోహాలు, వాటి సమ్మేళనాలు స్వాభావిక రంగులను ఇస్తాయి. కారణాలను వివరించండి.
జవాబు:
క్షారలోహాలు, వాటి సమ్మేళనాలు ఆక్సీకరణ జ్వాలకు స్వాభావిక రంగులను ఇస్తాయి. జ్వాల నుంచి ఉష్ణాన్ని గ్రహించి బాహ్య ఆర్బిటాల్ ఎలక్ట్రానన్ను పై శక్తిస్థాయికి ఉత్తేజపరుస్తాయి. ఉత్తేజిత ఎలక్ట్రాన్ స్థాయికి పడినప్పుడు వికిరణాలను ఉద్గారిస్తుంది. ఈ వికిరణాలు దృశ్య కాంతి ప్రాంతంలో ఉంటాయి. కావున ఇవి రంగులను ప్రదర్శిస్తాయి.
ప్రశ్న 30.
కాంతి విద్యుత్ ఘటాల ఎలక్ట్రోడ్లుగా సీసియమ్, పొటాషియమ్ ఏ ధర్మాలు ఉపయోగపడతాయి ?
జవాబు:
సీసియమ్, పొటాషియమ్లలో అయనీకరణ శక్తులు తక్కువగా ఉంటాయి. కాంతితో ఈ లోహాలను చర్య జరిపినపుడు ఆ లోహ పరమాణువులు ఎలక్ట్రాన్ కోల్పోవుటకు సరైన శక్తిని శోషించుకొంటాయి. కావున సీసియమ్, పొటాషియమ్లు కాంతి విద్యుద్ఘాటాల ఎలక్ట్రోడ్లుగా ఉపయోగపడతాయి.
ప్రశ్న 31.
క్షార లోహాలు గాలితో చర్యపై లఘు వ్యాఖ్యను రాయండి.
జవాబు:
క్షార లోహాలు గాలిలో చురుగ్గా మండి ఆక్సైడ్లను ఇస్తాయి. లిథియమ్ మోనాక్సైడ్నస్తుంది. 4Li + O2 → 2Li2O (లిథియమ్ మోనాక్సైడ్) సోడియమ్ ఆక్సిజన్తో మితంగాచర్య జరిపితే మోనాక్సైడ్ను, అధికంగా చర్యజరిపితే పెరాక్సైడ్ను ఏర్పరుస్తుంది.
4 Na + O2 (మితంగా) → 2Na2O (సోడియమ్ మోనాక్సైడ్)
2Na + O2 (అధికంగా) → Na2O2 (పెరాక్సైడ్)
మిగిలిన లోహాలు ఆక్సిజన్లో చర్య జరిపి సూపరాక్సైడ్లను ఏర్పరుస్తాయి.
M + O2 → MO2 (సూపరాక్సైడ్)
ప్రశ్న 32.
కింది లోహాలు ఒక్కొక్కదానికి ఏవైనా రెండు ఉపయోగాలను రాయండి.
(i) లిథియమ్
(ii) సోడియమ్
జవాబు:
i) లిథియమ్ ఉపయోగాలు.
a) మిశ్రమ లోహాల తయారీలో వాడతారు. ఉదా : Li – Pb మిశ్రమ లోహం మోటార్ ఇంజన్లలో బేరింగ్లుగా వాడతారు. Li – Al మిశ్రమ లోహాలు విమాన భాగాల తయారీలో వాడతారు.
b) Li ను ఉష్ణకేంద్రక చర్యలలోను, విద్యుత్ రసాయన ఘటాల తయారీలోను వాడతారు.
ii) సోడియమ్ లోహం – ఉపయోగాలు.
a) కర్బన రసాయన చర్యల్లో కారకంగా వాడతారు.
b) మిశ్రమ లోహాల తయారీలో వాడతారు.
c) శీతలకారిగా వాడతారు.
d) ఐసోప్రీన్ ను పాలిమరీకరణం చెందించి రబ్బర్ ఏర్పడటంలో ఉత్ప్రేరకంగా వాడతారు.
![]()
ప్రశ్న 33.
వాషింగ్ సోడా ధర్మాలను రాయండి.
జవాబు:
వాషింగ్ సోడా ధర్మాలు :
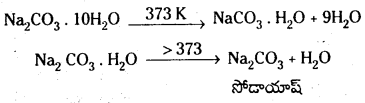
- Na2CO3 . 10H2O (డెకా హైడ్రేట్) ను వాషింగ్ సోడా అంటారు. ఇది తెల్లని, రంగులేని, స్ఫటిక ఘనపదార్థం.
- ఇది నీటిలో కరుగుతుంది.
- దీనిని వేడిచేయగా నీటి అణువులను కోల్పోయి మోనోహైడ్రేట్గా మారును. దీనిని 373K కంటే ఎక్కువగా వేడిచేసినపుడు సోడా యాషన్ను ఏర్పరచును.
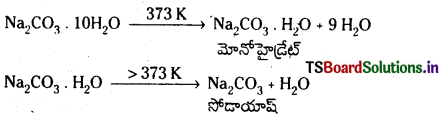
- Na2CO3 జలద్రావణం CO2 ను శోషించుకొని సోడియం బై కార్బొనేట్ను ఇస్తుంది.
Na2CO3 + H2O + CO2 → 2NaHCO3 - NO2CO3 ఆమ్లాలతో చర్య జరిపి CO2 వాయువును ఇస్తుంది.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
ఆనయాన్ జలవిశ్లేషణం వలన Na2CO3 జలద్రావణానికి క్షారస్వభావం ఉంటుంది. \(\mathrm{CO}_3^{-2}\) + H2O → HC\(\mathrm{O}_3^{-}\) + OH–
ప్రశ్న 34.
సోడియమ్ కార్బొనేట్ ఉపయోగాలను రాయండి.
జవాబు:
సోడియమ్ కార్బొనేట్ ముఖ్య ఉపయోగాలు
- మృదుజలాన్ని తయారుచేయటానికి, నేలను శుభ్రపరచటానికి Na2CO3 ను వాడతారు.
- లాండ్రీలలో Na2CO3 ను వాడతారు.
- గాజు, సబ్బు, బొరాక్స్, కాస్టిక్ సోడాల తయారీలో వాడతారు.
- కాగితం, రంగులు, వస్త్ర పరిశ్రమలలో వాడతారు.
![]()
ప్రశ్న 35.
ముడి సోడియమ్ క్లోరైడ్ నుంచి శుద్ధ లవణాన్ని మీరు ఎట్లా తయారుచేస్తారు ?
జవాబు:
ముడి సోడియమ్ క్లోరైడ్ నుంచి శుద్ధ లవణాన్ని తయారుచేయుట.
- ముడి NaCl నుంచి శుద్ధ లవణం చేయటానికి ముడి లవణాన్ని ముందుగా వీలైనంత కనీస నీటిలో కరిగించి, తరువాత వడబోస్తారు. నీటిలో కరగని మలినాలను తీసివేస్తారు.
- ద్రావణంలోనికి హైడ్రోజన్ క్లోరైడ్ వాయువును పంపి సంతృప్తపరుస్తారు. శుద్ధ NaCl స్ఫటికాలు వేరుపడతాయి.
- కాల్షియమ్ క్లోరైడ్, మెగ్నీషియమ్ క్లోరైడ్లు NaCl కంటే అధిక ద్రావణీయత కలవి కాబట్టి ద్రావణంలో మిగిలిపోతాయి.
ప్రశ్న 36.
కాష్టనర్-కెల్నర్ పద్ధతి గురించి మీకేమి తెలుసు ? దానిలో ఉన్న సూత్రాన్ని రాయండి.
జవాబు:
కాష్టనర్-కెల్నర్ ఘటంలో NaCl ను విద్యుద్విశ్లేషణ చేసి NaOH ను తయారుచేస్తారు. ఈ పద్ధతిలో మెర్క్యురీ కాథోడ్గాను, కార్బన్ ఆనోడ్గాను పనిచేస్తాయి. కాథోడ్ వద్ద ఏర్పడ్డ Na లోహం మెర్క్యురీతో సంయోగం చెంది సోడియమ్ ఎమాల్గమ్ను ఇస్తుంది. ఆనోడ్ వద్ద క్లోరిన్ వాయువు వెలువడుతుంది.
కాథోడ్ :
![]()
ఆనోడ్ : Cl– → \(\frac{1}{2}\) Cl2 + e– ఎమాల్గము నీటిలో అభిచర్య జరిపితే సోడియమ్ హైడ్రాక్సైడ్, హైడ్రోజన్ వాయువు వస్తాయి.
2Na – ఎమాల్గమ్ + 2H2O → 2NaOH + 2Hg + H2
ప్రశ్న 37.
కాస్టిక్ సోడా అనువర్తనాలను రాయండి.
జవాబు:
కాస్టిక్ సోడా యొక్క ఉపయోగాలు
- సబ్బు, కాగితం, కృత్రిమ సిల్క్ మరియు అనేక రసాయన పదార్థాల భారీ తయారీల్లో ఉపయోగిస్తారు.
- పెట్రోలియం శుద్ధి చేయడంలో ఉపయోగిస్తారు.
- బాక్సెట్ను శుద్ధి చేయడంలో ఉపయోగిస్తారు.
- శుద్ధ కొవ్వులను, నూనెలను తయారుచేయటానికి ఉపయోగిస్తారు.
- ప్రయోగశాలలో కారకంగా ఉపయోగిస్తారు.
![]()
ప్రశ్న 38.
Na+, K+ అయాన్ల ప్రాముఖ్యతను జీవరసాయన శాస్త్రంలో చెప్పండి.
జవాబు:
- కణాల్లోని కర్బన అణువులలో ఉన్న ఋణావేశాలను లోహ అయాన్లపై ఉండే ఆవేశాలు తుల్యం చేస్తాయి.
- కణాలలో ద్రవాభిసరణ పీడనాన్ని కూడా నిలకడగా ఉంచటానికి ఈ అయాన్లు సహయపడతాయి.
- కణపు పొరకు అటు, ఇటు రెండు పక్కల Na+, K+ అయాన్ లుంటాయి. దీని వలన కణంలో విద్యుత్ శక్మం ఏర్పడుతుంది. Na+ అయాన్లుండటం వలన గ్లూకోజ్ కణం లోపలికి వెళుతుంది. అధికంగా ఉన్న Na+ అయాన్లు బహిష్కృతమవుతాయి.
- పొటాషియమ్ అయాన్లు కణాంతర్భాగంలో గ్లూకోజ్ జీవన క్రియల్లో దోహదపడతాయి. ప్రోటీన్ సంశ్లేషణలోనూ, కొన్ని నిర్దిష్టమైన ఎంజైములు ఉత్తేజితమవటానికి సహాయపడుతుంది.
ప్రశ్న 39.
Mg లోహం ముఖ్య ఉపయోగాలను చెప్పండి.
జవాబు:
Mg లోహం ముఖ్య ఉపయోగాలు
- Mg లోహం Al, Zn, Mn మరియు Sn లలో ముఖ్యమైన మిశ్రమ లోహాలను ఏర్పరచును.
- మిల్క్ ఆఫ్ మెగ్నీషియమ్ను ఆమ్ల విరోధిగా వాడతారు.
- టూత్పేస్ట్లలో ఉపయోగిస్తారు.
- ఇన్ సెండియర్ బాంబ్లు మరియు సిగ్నలలో Mg ని ఉపయోగిస్తారు.
- Mg పొడి మరియు రిబ్బన్లను ఫ్లాష్ బల్బులలో ఉపయోగిస్తారు.
ప్రశ్న 40.
Be(OH)2 ద్విస్వభావ పదార్థం అని రుజువు చేయండి.
జవాబు:
బెరిలియమ్ హైడ్రాక్సైడ్ ఆమ్లాలతోను, క్షారాలతోను చర్య జరుపుతుంది. కాబట్టి దానికి ద్విస్వభావం ఉంటుంది.
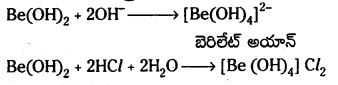
ప్రశ్న 41.
బెరిలియమ్ అసంగత ప్రవర్తన గురించి ఒక వ్యాఖ్యను రాయండి.
జవాబు:
బెరిలియమ్ అసంగత ప్రవర్తన.
బెరిలియమ్ అదే గ్రూపులోని ఇతర లోహాలతో పోలిస్తే అసంగత ప్రవర్తనని చూపిస్తుంది.
- బెరిలియమ్ పరమాణు, అయానిక పరిమాణాలు తక్కువగా ఉండటం వలన, ఇది ఎక్కువగా కోవలెంట్ సమ్మేళనాలను ఇస్తుంది. ఈ సమ్మేళనాలు తేలిగ్గా జలవిశ్లేషణ చెందుతాయి.
- Be సమన్వయ సంఖ్య 4. కాని మిగిలిన మూలకాలు d – ఆర్బిటాళ్ళను ఉపయోగించుకొని సమన్వయ సంఖ్య 6ను ప్రదర్శిస్తాయి.
- బెరిలియమ్ ఆక్సైడ్లు, హైడ్రాక్సైడ్లు ద్వి స్వభావాన్ని ప్రదర్శిస్తాయి.
ప్రశ్న 42.
Be, Al తో కర్ణ సంబంధం కలిగి ఉంటుంది. చర్చించండి.
జవాబు:
బెరిలియమ్, అల్యూమినియాతో కర్ణసంబంధాన్ని కలిగి ఉంటుంది.
- Al మాదిరిగానే Be కూడా ఆమ్లాలతో చర్య జరపదు.
- Be (OH)2 మరియు Al (OH)3 రెండు కూడా క్షారంలో కరిగి బేరిలేట్ అయాన్ [Be(OH)4]2- మరియు అల్యూమినేట్ అయాన్ (Al (OH4)]– లను ఏర్పరుస్తాయి.
- వాయు ప్రావస్థలో బెరిలియమ్, అల్యూమినియమ్ క్లోరైడ్లకు వంతెన నిర్మాణాలు ఉంటాయి.
- Be, Al రెండు కూడా సంక్లిష్టాలను ఏర్పరుస్తాయి.
- Be, Al క్లోరైడ్లు లూయీ ఆమ్లాలుగా పనిచేస్తాయి.
![]()
ప్రశ్న 43.
ప్లాస్టర్ ఆఫ్ పారిస్ అంటే ఏమిటి ? దాని మీద లఘు వ్యాఖ్యను రాయండి.
జవాబు:
కాల్షియమ్ సల్ఫేట్ హెమిహైడ్రేటిని (CaSO4 . \(\frac{1}{2}\)H2O) ప్లాస్టర్ ఆఫ్ పారిస్ అంటారు.
తయారి : జిప్సమ్ CaSO4. 2H2O ని 393 K వద్ద వేడిచేసి దీనిని తయారు చేస్తారు.
2(CaSO4 . 2H2O) → 2 (CaSO4) . H2O + 3H2O
393K కంటే అధిక ఉష్ణోగ్రతల వద్ద ప్లాస్టర్ ఆఫ్ పారిస్ నన్ను వేడిచేస్తే అనార్ద్ర CaSO, ఏర్పడుతుంది. దీనినే “డెడ్ బరస్ట్ ప్లాస్టర్” అంటారు.
ప్లాస్టర్ ఆఫ్ పారిస్కు తగినంత నీరు కలిపితే ప్లాస్టిక్ పదార్థం లాంటిది ఏర్పడుతుంది. ఈ పదార్థం 5 నుంచి 15 నిమిషాలలో గట్టిపడుతుంది.
ఉపయోగాలు :
- దీనిని గృహ నిర్మాణాల్లోను, ప్లాస్టర్లలోను అతి ఎక్కువగా ఉపయోగిస్తారు.
- ఎముకలు విరిగినా, నొప్పులు పట్టినా శరీర అవయవాలను కదలిక లేకుండా చేయటానికి దీనిని వాడతారు.
- దంతవైద్యంలో దీనిని వాడతారు.
ప్రశ్న 44.
రసాయన ప్రవృత్తిలో మెగ్నీషియమ్ లిథియమ్ ఏ రకంగా సారూప్యతను చూపిస్తుంది ?
జవాబు:
రసాయన ప్రవృత్తిలో Mg, Li ల సారూప్యత.
- Li, Mg లు నీటితో నెమ్మదిగా చర్య జరుపుతాయి. వాటి ఆక్సైడ్లు, హైడ్రాక్సైడ్లు తక్కువగా కరుగుతాయి.
- అవి రెండూ నైట్రోజన్లో చర్య జరిపి నైట్రైడ్లను ఏర్పరుస్తాయి.
- Li, Mg లు రెండూ కూడా ఆక్సిజన్తో చర్య జరిపి మోనాక్సైడ్లను ఏర్పరుస్తాయి.
- Li, Mg కార్బొనేట్లు వేడిచేస్తే తేలిగ్గా విఘటనం చెంది ఆక్సైడ్లను, CO2 ను ఇస్తాయి.
- LiCl, MgCl2 లు రెండూ చెమ్మగిల్లే పదార్థాలే. సజల ద్రావణాల నుంచి వాటి హైడ్రేట్లు LiCl. 2H2O, MgCl2 . 8H2O, స్ఫటికీకరణం చెందుతాయి.
ప్రశ్న 45.
ద్రవ అమ్మోనియాలో క్షార లోహాలను కరిగిస్తే, ద్రావణానికి వివిధ రంగులు వస్తాయి. ఈ రకమైన రంగుల్లో మార్పుకు కారణాలను వివరించండి.
జవాబు:
- క్షారలోహాలు ద్రవ అమ్మోనియాలో కరిగి ముదురు నీలిరంగు ద్రావణాలను ఇస్తాయి. ఈ ద్రావణాలకు విద్యుద్వాహక లక్షణం ఉంటుంది.
M + (x + y) NH3 → [M(NH3)x]+ + [e (NH3)4]– - ఈ నీలిరంగు ద్రావణంలో అమ్మోనియాలో ఎలక్ట్రాన్ కలిసి ఉంటుంది. ఈ ఎలక్ట్రాన్ దృగ్గోచర ప్రాంతంలో కాంతిని శోషించుకుంటుంది. కాబట్టి ద్రావణానికి నీలి రంగు వస్తుంది.
- ఈ ద్రావణాలు పారా అయస్కాంత ధర్మాన్ని కలిగి ఉంటాయి.
- గాఢ ద్రావణాన్ని వేడిచేస్తే నీలంరంగు కంచు రంగుగా మారుతుంది. ద్రావణం డయా అయస్కాంత ధర్మాన్ని కలిగి ఉంటుంది.
![]()
ప్రశ్న 46.
i) సోడియమ్ లోహాన్ని నీటిలో వేస్తే ఏమి జరుగుతుంది ?
ii) సోడియమ్ లోహానికి గాలిని స్వేచ్ఛగా సరఫరా చేస్తే ఏమి జరుగుతుంది?
జవాబు:
i) సోడియం లోహాన్ని నీటిలో వేస్తే H2 వాయువును విడుదల చేస్తుంది.
2Na + 2H2O → 2 NaOH + H2
ii) సోడియమ్ లోహానికి గాలిని స్వేచ్ఛగా సరఫరా చేస్తే సోడియమ్ పెరాక్సైడ్ ఏర్పడుతుంది.
2Na + O2 → Na2O2
ప్రశ్న 47.
కింది వాటికి కారణాలేమిటి ?
i) Na2CO3 జల ద్రావణం క్షార ధర్మం కలిగి ఉంటుంది.
ii) క్షార లోహాలను, వాటి గలన క్లోరైడ్లని విద్యుద్విశ్లేషణ చేసి తయారుచేస్తారు.
జవాబు:
i) Na2CO3 జల ద్రావణం క్షార స్వభావం కలిగి ఉంటుంది. నీటిలో ఆనయానిక్ జలవిశ్లేషణ జరిగి OH– అయాన్లు విడుదలవుతాయి. జలద్రావణం pH > 7 కావున ద్రావణం క్షార స్వభావం కలిగి ఉండును.
Na2CO3 → 2Na+ + C\(\mathrm{O}_3^{2-}\)
C\(\mathrm{O}_3^{2-}\) + H2O → HC\(\mathrm{O}_3^{-}\) + OH–
ii) క్షారలోహాలు బలమైన క్షయకరణులు. కావున రసాయన క్షయకరణ పద్ధతుల ద్వారా వీటిని తయారుచేయలేము. క్షారలోహ లవణ జల ద్రావణాలను విద్యుద్విశ్లేషణ చేస్తే క్షార లోహాలకు బదులుగా కాథోడ్ వద్ద H2 వాయువు విడుదలవుతుంది. కావున గలన క్లోరైడ్లను విద్యుద్విశ్లేషణ చేయటం ద్వారా మాత్రమే మనము క్షారలోహాలను తయారుచేస్తాము. ఉదా : గలన NaCl ను విద్యుద్విశ్లేషణ చేసి Na లోహాన్ని తయారుచేస్తాము.
ప్రశ్న 48.
కింది పరిశీలనలను మీరు ఎట్లా వివరిస్తారు ?
i) BeO దాదాపు కరగదు, కానీ BeSO4 నీటిలో కరుగుతుంది.
ii) BaO నీటిలో కరుగుతుంది, కానీ BaSO4 కరగదు.
జవాబు:
BeO లో జాలక ఎంథాల్పీ, హైడ్రేషన్ ఎంథాల్పీ కన్నా ఎక్కువగా ఉంటుంది. కావున అది నీటిలో కరగదు. కాని BeSO4 లో జాలక ఎంథాల్పీ హైడ్రేషన్ ఎంథాల్పీ కన్నా తక్కువగా ఉంటుంది. కావున అది నీటిలో కరుగుతుంది.
BaO లో జాలక ఎంథాల్పీ, హైడ్రేషన్ ఎంథాల్పీ కన్నా తక్కువగా ఉంటుంది. కావున అది నీటిలో కరుగుతుంది. BaSO4 లో జాలక ఎంథాల్పీ, హైడ్రేషన్ ఎంథాల్పీ కన్నా ఎక్కువగా ఉంటుంది. కావున అది నీటిలో కరగదు.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 49.
కింది అంశాలపరంగా క్షారలోహాలను ఒకే గ్రూపులో చేర్చడాన్ని సమర్థించండి.
i) ఎలక్ట్రానిక్ విన్యాసం,
ii) క్షయకరణి స్వభావం,
iii) ఆక్సైడ్లు, హైడ్రాక్సైడ్లు
జవాబు:
i) ఎలక్ట్రానిక్ విన్యాసం
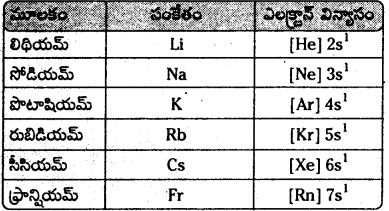
- క్షార లోహాల బాహ్య కక్షలో ఎలక్ట్రాన్ విన్యాసం ns1
- అన్ని మూలకాలు వేలన్సీ కక్షలో ఒక ఎలక్ట్రానన్ను కలిగి ఉంటాయి.
- ఒకే ఎలక్ట్రాన్ విన్యాసం కలిగి ఉండటం వలన ధర్మాలలో సారూప్యత కనిపిస్తుంది. కావున క్షారలోహాలన్నీ ఒకే గ్రూపులో ఉండటాన్ని సమర్థించవచ్చు.
ii) క్షయకరణ స్వభావం
- క్షారలోహాలు బలమైన క్షయకరణులు
- Li అధిక క్షయకరణ స్వభావం కలది. ‘Na’ తక్కువ క్షయకరణ స్వభావం కలది.
- క్షయకరణ స్వభావానికి ప్రమాణ విద్యుత్ పొటన్షియల్ (E0) ఒక కొలమానం.
- Li కు అధిక హైడ్రేషన్ ఎంథాల్పీ కలదు. దీనికి అధిక రుణాత్మక E° విలువ కలదు. కావున ఇది బలమైన క్షయకారిణి.
iii) a) ఆక్సైడ్లు : అన్ని క్షార లోహాలు మంచి క్షయకారిణులు. కాబట్టి వాటిని ఒకే గ్రూపులో ఉంచారు. క్షార లోహాలు గాలిలో చురుగ్గా మండి ఆక్సైడ్లను ఇస్తాయి. లిథియమ్ మోనాక్సైడ్నస్తుంది. 4Li + O2 → 2Li2O (లిథియమ్ మోనాక్సైడ్) సోడియమ్ ఆక్సిజన్ మితంగాచర్య జరిపితే మోనాక్సైడు, అధికంగా చర్యజరిపితే పెరాక్సైడ్ను ఏర్పరుస్తుంది.
4 Na + O2 (మితంగా) → 2Na2(సోడియమ్ మోనాక్సైడ్)
2 Na + O2 (అధికంగా) → 2Na2(పెరాక్సైడ్)
మిగిలిన లోహాలు ఆక్సిజన్తో చర్య జరిపి సూపరాక్సైడ్లను ఏర్పరుస్తాయి.
M + O2 → MO2 (సూపరాక్సైడ్)
క్షారలోహ అయాన్ పరిమాణం పెరిగిన కొలది జాలక శక్తి పెరుగుతుంది. కాబట్టి సూపరాక్సైడ్ స్థిరత్వం పెరుగుతుంది.
b) హైడ్రాక్సైడ్లు : క్షారలోహ ఆక్సైడ్లు జల విశ్లేషణ జరిపి హైడ్రాక్సైడ్లు ఏర్పరచును.
M2O + H2O → 2MOH
M2O2 + 2H2O → 2MOH + H2O2
2MO2 + 2H2O → 2MOH + H2O2 + O2 (M = క్షార లోహం)
- ఇవి రంగులేని స్ఫటిక ఘన పదార్ధాలు.
- ఇవి బలమైన క్షారాలు మరియు నీటిలో కరిగి ఉష్ణాన్ని విడుదల చేయును. కాబట్టి ఆక్సైడ్, హైడ్రాక్సైడ్ ధర్మాల పరంగా క్షారలోహాలను ఒకే గ్రూపులో చేర్చడం సమంజసం.
![]()
ప్రశ్న 50.
లిథియము, మిగిలిన క్షార లోహాలకు మధ్య తేడాలపై వ్యాసాన్ని రాయండి.
జవాబు:
గ్రూపులో ఇతర మూలకాలలో పోలిస్తే లిథియమ్ అసాధారణ ధర్మాలు ప్రదర్శిస్తుంది. లిథియమ్ అసాధారణ ప్రవర్తనకు
కారణాలు.
- అత్యంత తక్కువ పరమాణు సైజు, అయానిక సైజు ఉండటం.
- అత్యధిక ద్రువణ సామర్థ్యం ఉండటం.
వీటి ఫలితంగా లిథియమ్ సమ్మేళనాలకు కోవలెంట్ ధర్మాలు ఎక్కువవుతాయి. కావున అవి కర్బన ద్రావణుల్లో కరుగుతాయి.
లిథియమ్ అసాధారణ ధర్మాలు :
- లిథియమ్ మిగిలిన క్షారలోహాల కంటే గట్టిగా ఉంటుంది.
- క్షార లోహాల్లో Li అత్యల్ప చర్యాశీలత కలది. గాలిలో మండిస్తే మోనాక్సైడ్ను ఏర్పరుస్తుంది.
- లిథియమ్ నేరుగా N2 తో సంయోగం చెందుతుంది. ఏ ఇతర క్షారలోహం N2 తో చర్య జరపదు.
- లిథియమ్ హైడ్రోజన్ కార్బొనేట్ ఘనరూపంలో లభ్యం కాదు. మిగిలిన మూలకాలు ఘన హైడ్రోజన్ కార్బొనేట్లను ఏర్పరుస్తాయి.
- లిథియమ్ నైట్రేట్ను వేడిచేస్తే లిథియమ్ ఆక్సైడ్ ఏర్పడుతుంది. ఇతర క్షారలోహాల నైట్రేట్లు విఘటనం చెంది నైట్రైట్లను ఇస్తాయి.
4 LiNO3 → 2 Li2O + 4 NO2 + O2
2MaNO3 → 2MaNO2 + O2 - LiF, Li2O లు వాటి అనురూప క్షారలోహాల సమ్మేళనాలకంటే నీటిలో సాపేక్షంగా తక్కువగా కరుగుతాయి.
ప్రశ్న 51.
సోడియమ్ కార్బొనేట్ని తయారుచేయడం, దాని ధర్మాలను చర్చించండి.
జవాబు:
సోడియమ్ కార్బొనేట్ను సాధారణంగా సాల్వే పద్ధతిలో తయారు చేస్తారు. ఈ పద్ధతిలో Na2CO3 ను క్రింది విధంగా తయారు చేస్తారు.
- అమ్మోనియా ద్రావణంలోనికి CO2 వాయువును పంపితే అమ్మోనియం బై కార్బొనేట్ ఏర్పడుతుంది.
NH3 + H2O + CO2 → NH4HCO3 - ఏర్పడిన అమ్మోనియమ్ బైకార్బొనేట్ను సోడియమ్ క్లోరైడ్తో చర్య జరిపిస్తే సోడియమ్ బైకార్బొనేట్ ఏర్పడుతుంది.
NH4HCO3 + NaCl → NH4Cl + NaHCO3 - సోడియమ్ బైకార్బొనేట్ను వేడిచేస్తే సోడియమ్ కార్బొనేట్ ఏర్పడుతుంది.
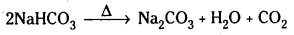
ధర్మాలు :
- సోడియమ్ కార్బొనేట్ తెల్లని, స్ఫటిక పదార్థం.
- Na2CO3 . 10H2O ను డెకాహైడ్రేట్ అంటారు. దీనిని వాషింగ్ సోడా అంటారు.
- 373 K కంటే ఎక్కువ ఉష్ణోగ్రతల వద్ద దీనిని వేడిచేస్తే పూర్తిగా అనార్ద్రంగా తయారవుతుంది. దీనినే సోడాయాష్ అంటారు.
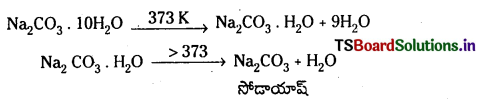
- Na2CO3 లోని కార్బొనేట్ భాగం నీటిలో జలవిశ్లేషణ చెంది క్షార ద్రావణాన్ని ఇస్తుంది.
C\(\mathrm{O}_3^{2-}\) + H2O → HC\(\mathrm{O}_3^{-}\) + OH– - ఇది ఆమ్లాలతో చర్య జరిపి, CO2 వాయువును ఇస్తుంది. Na2CO3 + 2HCl → 2 Nacl + H2O + CO2
ప్రశ్న 52.
కింది అంశాలపరంగా క్షార మృత్తికలోహాల సారూప్యతను చర్చించండి.
i) ఎలక్ట్రానిక్ విన్యాసం,
ii) ఆర్ద్రీకరణోషాలు,
iii) ఆక్సైడ్లు, హైడ్రాక్సైట్ల స్వభావాలు
జవాబు:
i) ఎలక్ట్రానిక్ విన్యాసం :
- క్షారమృత్తిక లోహాల సాధారణ ఎలక్ట్రాన్ విన్యాసం ns2.
- ఈ మూలకాల వేలన్సీ కక్ష s – ఆర్బిటాల్లో రెండు ఎలక్ట్రాన్లు ఉంటాయి. కావున ఈ మూలకాల ధర్మాలలో సారూప్యత కనిపిస్తుంది.
ii) ఆర్ద్రీకరణోష్టాలు
- క్షార మృత్తిక లోహాల ఆర్ద్రీకరణోష్టాలు లోహ అయాన్ పరిమాణం పెరిగేకొలది తగ్గుతాయి.
Be2+ > Mg+2 > Ca+2 > Sr+2 > Ba+2 - క్షార లోహ అయాన్ల ఆర్ద్రీకరణోష్టాల కంటే క్షార మృత్తిక లోహాలకు ఆర్ద్రీకరణోష్టాలు ఎక్కువగా ఉంటాయి.
iii) a. ఆక్సైడ్లు
- క్షారమృత్తిక లోహాలు ఆక్సిజన్లో మండి మోనాక్సైడ్లను ఏర్పరుస్తాయి.
- BeO ద్విస్వభావ సంయోజనీయ ఆక్సైడ్. మిగతా ఆక్సైడ్లు అయానిక క్షార స్వభావం కలిగి ఉంటాయి.
b. హైడ్రాక్సైడ్లు
- BéO తప్ప మిగిలిన ఆక్సైడ్లు జల విశ్లేషణ చేసినపుడు హైడ్రాక్సెడ్లు ఏర్పడతాయి.
- క్షారలోహ హైడ్రాక్సైడ్ కంటే క్షార మృత్తికలోహ హైడ్రాక్సెడ్లు తక్కువ క్షార స్వభావం కలిగి ఉంటాయి.
- Be(OH)2 ద్విస్వభావ పదార్థం అంటే ఇది ఆమ్లాలతోనూ, క్షారాలతోనూ చర్య జరుపుతుంది.
ప్రశ్న 53.
క్షారమృత్తిక లోహాల
i) కార్బొనేట్లు
ii) సల్ఫేట్లు
iii)నైట్రేట్ల గురించి చర్చించండి.
జవాబు:
i) కార్బొనేట్లు
- క్షార మృత్తిక లోహాలు MCO3 రకమైన కార్బొనేట్లను ఏర్పరుస్తాయి.
నీటిలో కరిగే లోహ లవణ ద్రావణాలకు Na2CO3 ద్రావణాన్ని కలిపి ఈ కార్బొనేట్లను తయారుచేస్తారు. - గ్రూపులో పై నుంచి క్రిందకు పరమాణు సంఖ్య పెరిగే కొలది కార్బనేట్ల ద్రావణీయతలు తగ్గుతాయి.
- ఈ కార్బొనేట్లు వేడిచేయగా వియోగం చెంది CO2 ను ఏర్పరచును.
ii) సల్ఫేట్లు
- క్షార మృత్తిక లోహాలు MSO4 రకమైన సల్ఫేట్లను ఏర్పరుస్తాయి.
- ఇవి తెల్లని ఘన పదార్థాలు. ఉష్ణ స్థిరమైనవి.
- Be+2, Mg+2 కు ఆర్ద్రీకరణోష్ణం ఎక్కువ. అందువలన BeSO4 మరియు MgSO4 లు నీటిలో కరుగుతాయి.
- CaSO4 నుంచి BaSO4 కు ద్రావణీయత తగ్గును.
iii) నైట్రేట్లు
- క్షారమృత్తిక లోహాలు M(NO3)2 రకమైన నైట్రేట్లను ఏర్పరుస్తాయి.
- ఇవి కార్బొనేట్లను సజల HNO3 తో చర్యజరపడం ద్వారా ఏర్పడతాయి.
- Mg(NO3)2 ఆరు నీటి అణువులతో స్పటికీకరణం చెందును. Ba(NO3)2 అనార్ధమైనవి.
- ఈ నైట్రేట్లను వేడిచేయగా ఆక్సైడ్లను ఏర్పరచును.
2 M(NO3)2 → 2MO + 4NO2 + O2
![]()
ప్రశ్న 54.
క్షారలోహాల సాధారణ భౌతిక, రసాయన ధర్మాలు ఏమిటి ?
జవాబు:
భౌతిక ధర్మాలు :
- క్షారలోహాలన్నీ తెల్లని మెత్తని తేలికైన లోహాలు.
- సైజు ఎక్కువగా ఉండటం వలన సాంద్రత తక్కువగా ఉంటుంది.
- వీటి ద్రవీభవన, బాష్పీభవన స్థానాలు తక్కువగా ఉంటాయి.
- క్షారలోహాలు, వాటి లవణాలు ఆక్సీకరణ జ్వాలకు విలక్షణమైన రంగునిస్తాయి.
- ఇవి బలమైన క్షయకరణులు
రసాయన ధర్మాలు :
- O2 తో చర్య : క్షారలోహాలన్నీ ఆక్సిజన్లో వేడిచేసినపుడు ఆక్సైడ్లను ఇస్తాయి. లిథియమ్ O2 తో మోనాక్సైడు, సోడియమ్ పెరాక్సైడ్ను, మిగిలిన మూలకాలతో సూపరాక్సైడ్లను ఏర్పరుస్తాయి.
- H2 తో చర్య : క్షారలోహాలు 300-600°C వద్ద H2 తో సంయోగం చెంది హైడ్రైడ్లనిస్తాయి.
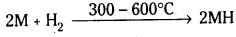
- ఈ హైడ్రైడ్లన్నీ అయానిక పదార్థాలు.
నీటితో చర్యాశీలత : క్షారలోహాలు నీటితో తీవ్రమైన చర్య జరుపుతాయి. ఈ చర్యలో H2 వాయువు విడుదలవుతుంది.
2M + 2H2O → 2MOH + H2 (M = క్షార లోహం)
హాలోజన్లతో చర్య : క్షారలోహాలు హాలోజన్లతో సంయోగం చెంది ద్విగుణాత్మక సమ్మేళనాలనిస్తాయి.
2M + X2 → 2MX (M = క్షార లోహం)
క్షారలోహాల హాలైడ్ల న్నీ అయానిక సమ్మేళనాలే.
ప్రశ్న 55.
క్షార మృత్తిక లోహాల సాధారణ ధర్మాలని, వాటిలోని క్రమతను గురించి చర్చించండి.
జవాబు:
i) ఎలక్ట్రానిక్ విన్యాసం :
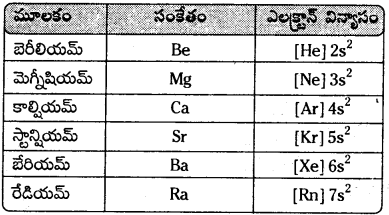
- క్షారమృత్తిక లోహాల సాధారణ ఎలక్ట్రాన్ విన్యాసం ns2.
- ఈ మూలకాల వేలన్సీ కక్ష s – ఆర్బిటాల్లో రెండు ఎలక్ట్రాన్లు ఉంటాయి. కావున ఈ మూలకాల ధర్మాలలో సారూప్యత కనిపిస్తుంది.
ii) ఆర్ద్రీకరణోష్టాలు
- క్షార మృత్తిక లోహాల ఆర్ద్రీకరణోష్టాలు లోహ అయాన్ పరిమాణం పెరిగేకొలది తగ్గుతాయి.
Be2+ > Mg+2 > Ca+2 > Sr+2 > Ba+2 - క్షార లోహ అయాన్ల ఆర్ద్రీకరణోష్టాల కంటే క్షార మృత్తిక లోహాలకు ఆర్ద్రీకరణోష్టాలు ఎక్కువగా ఉంటాయి.
iii) a. ఆక్సైడ్లు
- క్షారమృత్తిక లోహాలు ఆక్సిజన్లో మండి మోనాక్సైడ్లను ఏర్పరుస్తాయి.
- BeO ద్విస్వభావ సంయోజనీయ ఆక్సైడ్. మిగతా ఆక్సైడ్లు అయానిక క్షార స్వభావం కలిగి ఉంటాయి.
b. హైడ్రాక్సైడ్లు
- BeO తప్ప మిగిలిన ఆక్సైడ్లు జల విశ్లేషణ చేసినపుడు హైడ్రాక్సైడ్లు ఏర్పడతాయి.
i) కార్బొనేట్లు
- క్షార మృత్తిక లోహాలు MCO3 రకమైన కార్బొనేట్లను ఏర్పరుస్తాయి.
- నీటిలో కరిగే లోహ లవణ ద్రావణాలకు Na2CO3 ద్రావణాన్ని కలిపి ఈ కార్బొనేట్లను తయారుచేస్తారు.
- గ్రూపులో పై నుంచి క్రిందకు పరమాణు సంఖ్య పెరిగే కొలది కార్బొనేట్ల ద్రావణీయతలు తగ్గుతాయి.
- ఈ కార్బొనేట్లు వేడిచేయగా వియోగం చెంది CO2 ను ఏర్పరచును.
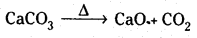
ii) సల్ఫేట్లు
- క్షార మృత్తిక లోహాలు MSO4 రకమైన సల్ఫేట్లను ఏర్పరుస్తాయి.
- ఇవి తెల్లని ఘన పదార్థాలు. ఉష్ణ స్థిరమైనవి.
- Be+2; Mg+2 కు ఆర్ద్రీకరణోష్ణం ఎక్కువ. అందువలన BeSO4 మరియు MgSO4 లు నీటిలో కరుగుతాయి.
- CaSO4 నుంచి BaSO4 కు ద్రావణీయత తగ్గును.
iii) నైట్రేట్లు
- క్షారమృత్తిక లోహాలు M(NO3)2 రకమైన నైట్రేట్లను ఏర్పరుస్తాయి.
- ఇవి కార్బొనేట్లు సజల HNO3 తో చర్య ద్వారా ఏర్పడతాయి.
- Mg(NO3)2 ఆరు నీటి అణువులతో స్పటికీకరణం చెందును. Ba(NO3)2 అనార్ధమైనవి.
- ఈ నైట్రేట్లను వేడిచేయగా ఆక్సైడ్లను ఏర్పరచును.
2 M(NO3)2 → 2MO + 4NO2 + O2
ప్రశ్న 56.
సాల్వే పద్దతిలో జరిగే వివిధ చర్యలను చర్చించండి.
జవాబు:
సోడియమ్ కార్బొనేట్ను సాధారణంగా సాల్వే పద్ధతిలో తయారు చేస్తారు. ఈ పద్ధతిలో Na2CO3 ను క్రింది విధంగా తయారు చేస్తారు.
- అమ్మోనియా ద్రావణంలోనికి CO2 వాయువును పంపితే అమ్మోనియం బై కార్బొనేట్ ఏర్పడుతుంది.
NH3 + H2O + CO2 → NH4HCO3 - ఏర్పడిన అమ్మోనియమ్ బైకార్బొనేట్ను సోడియమ్ క్లోరైడ్తో చర్య జరిపిస్తే సోడియమ్ బైకార్బొనేట్ ఏర్పడుతుంది. Na4HCO3 →
NH4Cl + NaHCO3 - సోడియం బైకార్బొనేటును వేడిచేస్తే సోడియం కార్బొనేటు ఏర్పడుతుంది.
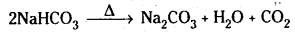
ధర్మాలు :
- సోడియమ్ కార్బొనేట్ తెల్లని, స్ఫటిక పదార్థం.
- Na2CO3 . 10H2O ను డెకా హైడ్రేట్ అంటారు. దీనిని వాషింగ్ సోడా అంటారు.
- 373 K కంటే ఎక్కువ ఉష్ణోగ్రతల వద్ద దీనిని వేడిచేస్తే పూర్తిగా అనార్ధంగా తయారవుతుంది. దీనినే సోడాయాష్ అంటారు.
- Na2CO3 లోని కార్బొనేట్ భాగం నీటిలో జలవిశ్లేషణ చెంది క్షార ద్రావణాన్ని ఇస్తుంది.
C\(\mathrm{O}_3^{2-}\) + H2O →HC\(\mathrm{O}_3^{-}\) + OH–
ప్రశ్న 57.
సోడియమ్ క్లోరైడ్ నుంచి కింది వాటిని ఎట్లా తయారుచేస్తారు ?
i) సోడియమ్ లోహం
ii) సోడియమ్ హైడ్రాక్సైడ్
iii)సోడియమ్ పెరాక్సైడ్
iv) సోడియమ్ కార్బొనేట్
జవాబు:
సోడియమ్ క్లోరైడ్ నుంచి Na లోహం తయారుచేయుట
గలన NaCl ను విద్యుద్విశ్లేషణ చేయగా Na లోహం ఏర్పడును.
2NaCl → 2Na + Cr
కాథోడ్ వద్ద 2Na+ + 2e– → Na
ఆనోడ్ వద్ద 2Cl– → Cl2 + 2e–
సోడియమ్ క్లోరైడ్ నుంచి NaOH తయారుచేయుట
NaCl జలద్రావణాన్ని విద్యుద్విశ్లేషణ చేయగా NaOH ఏర్పడును.
NaCl → Na+ + Cl–
H2O → H+ + OH–
ఆనోడ్ వద్ద 2Cl– → Cl2 + 2e–
కాథోడ్ వద్ద 2H,sup>+ + 2e– → H2
Na+ + OH– → NaOH
NaCl నుంచి సోడియమ్ పెరాక్సైడ్ను తయారుచేయుట
మొదట గలన NaCl ను విద్యుద్విశ్లేషణ చేసి Na లోహం తయారుచేస్తారు. Na ను అదిక 0 తో మండిస్తే సోడియమ్ పెరాక్సైడ్ ఏర్పడుతుంది.
2Na + O2 → Na2O2
NaCl నుంచి సోడియమ్ కార్బొనేట్ను తయారుచేయుట
అమ్మోనియా ద్రావణంలోకి CO2 వాయువును పంపితే అమ్మోనియం బై కార్బొనేట్ ఏర్పడుతుంది. అమ్మోనియం బై కార్బొనేట్ను NaCl తో చర్య జరిపితే సోడియమ్ బైకార్బొనేట్ ఏర్పడుతుంది. సోడియమ్ బై కార్బొనేటును వేడిచేస్తే సోడియమ్ కార్బొనేటు ఏర్పడుతుంది.
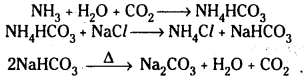
ప్రశ్న 58.
i) మెగ్నీషియమ్ని గాలిలో వేడిచేస్తే
ii) పొడిసున్నాన్ని సిలికాతో వేడిచేస్తే
iii) తడిసున్నంతో క్లోరిన్ చర్య
iv) కాల్షియమ్ నైట్రేట్ని బాగా వేడిచేస్తే, ఏం జరుగుతుంది ?
జవాబు:
i) Mg ని గాలిలో మండించినపుడు కాంతివంతంగా మండి MgO మరియు Mg3N2 లను ఏర్పరచును.
2Mg + O2 → 2MgO (మెగ్నీషియమ్ ఆక్సైడ్)
3Mg + N2 → Mg3N2 (మెగ్నీషియమ్ నైట్రెడ్)
ii) పొడిసున్నాన్ని సిలికాతో వేడిచేస్తే కాల్షియమ్ సిలికేట్ ఏర్పడుతుంది.
CaO + SiO2 → CaSiO3
iii) తడిసున్నం క్లోరిన్తో చర్య జరిపి బ్లీచింగ్ పౌడర్ను ఏర్పరచును.
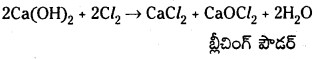
iv) కాల్షియమ్ నైట్రేట్ను బాగా వేడిచేస్తే అది విఘటనం చెంది CaO, NO2 మరియు O2 లను ఏర్పరచును.
2 Ca(NO3)2 → 2CaO + 4NO2 + O2
ప్రశ్న 59.
జీవశాస్త్ర ప్రవాహికల్లో సోడియమ్, పొటాషియమ్, మెగ్నీషియమ్, కాల్షియమ్ల సార్ధకతను వివరించండి. (March 2013)
జవాబు:
జీవశాస్త్ర ప్రవాహికల్లో Na, Kల పాత్ర
- కణాల్లోని కర్బన అణువులలో ఉన్న ఋణావేశాలను లోహ అయాన్లపై ఉండే ఆవేశాలు తుల్యం చేస్తాయి.
- కణాలలో ద్రవాభిసరణ పీడనాన్ని కూడా నిలకడగా ఉంచటానికి ఈ అయాన్లు సహాయపడతాయి.
- కణపు పొరకు అటు, ఇటు రెండు పక్కల Na+, K+ అయాన్ లుంటాయి. దీని వలన కణంలో విద్యుత్ శక్మం ఏర్పడుతుంది. Na+ అయాన్లుండటం వలన గ్లూకోజ్ కణం లోపలికి వెళుతుంది. అధికంగా ఉన్న Na+ అయాన్లు బహిష్కృతమవుతాయి.
- పొటాషియమ్ అయాన్లు కణాంతర్భాగంలో గ్లూకోజ్ జీవన క్రియల్లో దోహదపడతాయి. ప్రోటీన్ సంశ్లేషణలోనూ, కొన్ని నిర్దిష్టమైన ఎంజైములు ఉత్తేజితమవటానికి సహాయపడుతుంది.
జీవశాస్త్రంలో Mg పాత్ర :
- జంతు కణాలలో Mg+2 అయాన్ల గాఢత ఎక్కువగా ఉంటుంది.
- ఫాస్ఫోహైడ్రోలేజ్లు, ఫాస్పోట్రాన్స్ఫరేజ్లు వంటి ఎంజైములలో Mg+2 ఉంటుంది. ఈ ఎంజైములు ATP చర్యలలో పాల్గొని శక్తిని విడుదల చేస్తాయి.
- క్లోరోఫిల్ చెట్లలోని ఆకుపచ్చ పదార్థం. ఇందులో Mg+2 ఉంటుంది.
జీవశాస్త్రంలో Ca పాత్ర
- మన శరీరంలో 99% కాల్షియమ్ అయాన్లు ఎముకలు మరియు దంతాల తయారీలో ఉపయోగపడతాయి.
- రక్త స్కందనములో మరియు కణపొర అయాన్ బదిలీ కార్యక్రమంలో ఈ అయాన్ ముఖ్య పాత్ర వహిస్తుంది.
- కాల్షియమ్ అయాన్లు గుండె క్రమంగా కొట్టుకొనే ప్రక్రియలో మరియు కండరాల సంకోచ ప్రక్రియలో కూడా ముఖ్యపాత్రను వహిస్తాయి.
![]()
ప్రశ్న 60.
సిమెంట్ని గురించి కొన్ని వాక్యాలు రాయండి.
జవాబు:
- సిమెంట్ ఒక ముఖ్యమైన నిర్మాణోపయోగకరమైన పదార్థం. దీనిని 1824లో జోసఫ్ ఆస్పిడిన్ మొట్టమొదటగా ఇంగ్లాండ్లో ప్రవేశపెట్టాడు. దీనినే పోర్ట్లాండ్ సిమెంట్ అంటారు.
- పొర్ట్ లాండ్ సిమెంట్ సగటు సంఘటనం కింది విధంగా ఉంటుంది. Ca0, 50-60%, SiO2, 20 – 25%; Al2O3, 5 – 10%; MgO, 2 – 3%; Fe2O3, 1 – 2%; SO3, 1 – 2%
- మంచిరకం సిమెంట్ సిలికా (SiO2) కి అల్యూమినా (Al2O3) కి ఉండే నిష్పత్తి 2.5 నుంచి 4.0 మధ్యలో
ఉండాలి. - బంకమట్టిని సున్నంతో కలిపి బాగా వేడిచేస్తే అవి ద్రవీభవించి, చర్య జరిపి “సిమెంట్ క్లింకర్” ని ఏర్పరుస్తాయి. ఈ క్లింకర్ను 2-3% జిప్సమ్ కలిపితే సిమెంట్ వస్తుంది.
- సిమెంటు నీటిని కలిపితే గట్టి పదార్థంగా ఏర్పడుతుంది. ఈ ప్రక్రియను “సెట్టింగ్ ఆఫ్ సిమెంట్” అంటారు.
సిమెంట్ ఉపయోగాలు :
- సిమెంటు కాంక్రీట్ మరియు ప్రబలిత కాంక్రీట్లలో ఉపయోగిస్తారు.
- ప్లాస్టరింగ్లో ఉపయోగిస్తారు.
- వారధులను, డ్యామ్లను, భవంతులను నిర్మించుటకు ఉపయోగిస్తారు.